+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2gbq | ||||||
|---|---|---|---|---|---|---|---|
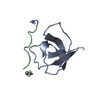
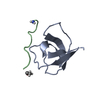
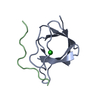
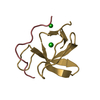
| タイトル | SOLUTION NMR STRUCTURE OF THE GRB2 N-TERMINAL SH3 DOMAIN COMPLEXED WITH A TEN-RESIDUE PEPTIDE DERIVED FROM SOS DIRECT REFINEMENT AGAINST NOES, J-COUPLINGS, AND 1H AND 13C CHEMICAL SHIFTS, 15 STRUCTURES | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | COMPLEX (SIGNAL TRANSDUCTION/PEPTIDE) / COMPLEX (SIGNAL TRANSDUCTION-PEPTIDE) /  SH3 DOMAIN (SH3ドメイン) / COMPLEX (SIGNAL TRANSDUCTION-PEPTIDE) complex SH3 DOMAIN (SH3ドメイン) / COMPLEX (SIGNAL TRANSDUCTION-PEPTIDE) complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Signalling to RAS / Activated NTRK2 signals through FRS2 and FRS3 / SHC1 events in ERBB4 signaling / GRB2 events in ERBB2 signaling / EGFR Transactivation by Gastrin / SHC-mediated cascade:FGFR3 / SHC-mediated cascade:FGFR4 / SHC-mediated cascade:FGFR1 / SHC-mediated cascade:FGFR2 / MET activates PI3K/AKT signaling ...Signalling to RAS / Activated NTRK2 signals through FRS2 and FRS3 / SHC1 events in ERBB4 signaling / GRB2 events in ERBB2 signaling / EGFR Transactivation by Gastrin / SHC-mediated cascade:FGFR3 / SHC-mediated cascade:FGFR4 / SHC-mediated cascade:FGFR1 / SHC-mediated cascade:FGFR2 / MET activates PI3K/AKT signaling / PI-3K cascade:FGFR3 / PI-3K cascade:FGFR4 / SHC-related events triggered by IGF1R / Signal regulatory protein family interactions / PI-3K cascade:FGFR1 / PI-3K cascade:FGFR2 / SOS-mediated signalling / FRS-mediated FGFR3 signaling / FRS-mediated FGFR4 signaling / MET activates RAS signaling / MET activates PTPN11 / Costimulation by the CD28 family / FRS-mediated FGFR1 signaling / FRS-mediated FGFR2 signaling / PI3K events in ERBB2 signaling / Tie2 Signaling / GRB2 events in EGFR signaling / SHC1 events in EGFR signaling / Interleukin-15 signaling / FLT3 Signaling / CD28 dependent Vav1 pathway / MET activates RAP1 and RAC1 / RHOU GTPase cycle / Signaling by CSF3 (G-CSF) / MET receptor recycling / NCAM signaling for neurite out-growth / Erythropoietin activates RAS / Regulation of KIT signaling / GAB1 signalosome / Role of LAT2/NTAL/LAB on calcium mobilization / PI3K Cascade / Negative regulation of FGFR3 signaling / Negative regulation of FGFR4 signaling / anatomical structure formation involved in morphogenesis / Downstream signal transduction / Negative regulation of FGFR1 signaling / Negative regulation of FGFR2 signaling / Spry regulation of FGF signaling / Insulin receptor signalling cascade / FCERI mediated MAPK activation / Negative regulation of MET activity / lymphocyte homeostasis / Signal attenuation / RHO GTPases Activate WASPs and WAVEs / NRAGE signals death through JNK / Signaling by SCF-KIT / EGFR downregulation / RAC1 GTPase cycle / GRB2:SOS provides linkage to MAPK signaling for Integrins / guanyl-nucleotide exchange factor adaptor activity / FCERI mediated Ca+2 mobilization / Grb2-EGFR complex / RAF/MAP kinase cascade / Interleukin receptor SHC signaling / G alpha (12/13) signalling events / midbrain morphogenesis / PIP3 activates AKT signaling / regulation of pro-B cell differentiation / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / Regulation of signaling by CBL /  vitellogenesis / Regulation of actin dynamics for phagocytic cup formation / pericardium morphogenesis / cardiac atrium morphogenesis / Cargo recognition for clathrin-mediated endocytosis / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / branching involved in labyrinthine layer morphogenesis / vitellogenesis / Regulation of actin dynamics for phagocytic cup formation / pericardium morphogenesis / cardiac atrium morphogenesis / Cargo recognition for clathrin-mediated endocytosis / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / branching involved in labyrinthine layer morphogenesis /  Clathrin-mediated endocytosis / RET signaling / heart trabecula morphogenesis / Clathrin-mediated endocytosis / RET signaling / heart trabecula morphogenesis /  COP9 signalosome / neurotrophin TRKA receptor binding / vesicle membrane / regulation of T cell differentiation in thymus / COP9 signalosome / neurotrophin TRKA receptor binding / vesicle membrane / regulation of T cell differentiation in thymus /  transmembrane receptor protein tyrosine kinase adaptor activity / transmembrane receptor protein tyrosine kinase adaptor activity /  GTPase complex / positive regulation of small GTPase mediated signal transduction / positive regulation of Ras protein signal transduction / blood vessel morphogenesis / DAP12 signaling / positive regulation of epidermal growth factor receptor signaling pathway / GTPase complex / positive regulation of small GTPase mediated signal transduction / positive regulation of Ras protein signal transduction / blood vessel morphogenesis / DAP12 signaling / positive regulation of epidermal growth factor receptor signaling pathway /  epidermal growth factor receptor binding / small GTPase-mediated signal transduction / positive regulation of actin filament polymerization / regulation of T cell proliferation / ERBB2-ERBB3 signaling pathway / roof of mouth development / eyelid development in camera-type eye / endodermal cell differentiation / epidermal growth factor receptor binding / small GTPase-mediated signal transduction / positive regulation of actin filament polymerization / regulation of T cell proliferation / ERBB2-ERBB3 signaling pathway / roof of mouth development / eyelid development in camera-type eye / endodermal cell differentiation /  regulation of MAPK cascade regulation of MAPK cascade類似検索 - 分子機能 | ||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ) | ||||||
| 手法 |  溶液NMR / DG, SA 溶液NMR / DG, SA | ||||||
 データ登録者 データ登録者 | Wittekind, M. / Mapelli, C. / Lee, V. / Goldfarb, V. / Friedrichs, M.S. / Meyers, C.A. / Mueller, L. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 1997 ジャーナル: J.Mol.Biol. / 年: 1997タイトル: Solution structure of the Grb2 N-terminal SH3 domain complexed with a ten-residue peptide derived from SOS: direct refinement against NOEs, J-couplings and 1H and 13C chemical shifts. 著者: Wittekind, M. / Mapelli, C. / Lee, V. / Goldfarb, V. / Friedrichs, M.S. / Meyers, C.A. / Mueller, L. #1:  ジャーナル: Biochemistry / 年: 1994 ジャーナル: Biochemistry / 年: 1994タイトル: Orientation of Peptide Fragments from SOS Proteins Bound to the N-Terminal SH3 Domain of Grb2 Determined by NMR Spectroscopy 著者: Wittekind, M. / Mapelli, C. / Farmer II, B.T. / Suen, K.L. / Goldfarb, V. / Tsao, J. / Lavoie, T. / Barbacid, M. / Meyers, C.A. / Mueller, L. #2:  ジャーナル: Mol.Cell.Biol. / 年: 1993 ジャーナル: Mol.Cell.Biol. / 年: 1993タイトル: Molecular Cloning of the Mouse Grb2 Gene: Differential Interaction of the Grb2 Adaptor Protein with Epidermal Growth Factor and Nerve Growth Factor Receptors 著者: Suen, K.L. / Bustelo, X.R. / Pawson, T. / Barbacid, M. #3:  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 1992 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 1992タイトル: Identification of Murine Homologues of the Drosophila Son of Sevenless Gene: Potential Activators of Ras 著者: Bowtell, D. / Fu, P. / Simon, M. / Senior, P. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2gbq.cif.gz 2gbq.cif.gz | 324.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2gbq.ent.gz pdb2gbq.ent.gz | 279.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2gbq.json.gz 2gbq.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/gb/2gbq https://data.pdbj.org/pub/pdb/validation_reports/gb/2gbq ftp://data.pdbj.org/pub/pdb/validation_reports/gb/2gbq ftp://data.pdbj.org/pub/pdb/validation_reports/gb/2gbq | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 |  分子量: 8454.495 Da / 分子数: 1 / 断片: N-TERMINAL SH3 DOMAIN / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 株: BALB/C / 細胞株: BL21 / 細胞内の位置: CYTOPLASMIC Mus musculus (ハツカネズミ) / 株: BALB/C / 細胞株: BL21 / 細胞内の位置: CYTOPLASMIC 細胞質 / 遺伝子: POTENTIAL / プラスミド: BL21 / 生物種 (発現宿主): Escherichia coli / 発現宿主: 細胞質 / 遺伝子: POTENTIAL / プラスミド: BL21 / 生物種 (発現宿主): Escherichia coli / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21 (DE3) / 参照: UniProt: Q60631 Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21 (DE3) / 参照: UniProt: Q60631 |
|---|---|
| #2: タンパク質・ペプチド | 分子量: 1197.478 Da / 分子数: 1 / 断片: RESIDUES 1135 - 1144 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 細胞内の位置: CYTOPLASM Mus musculus (ハツカネズミ) / 細胞内の位置: CYTOPLASM 細胞質 / 参照: UniProt: Q62245 細胞質 / 参照: UniProt: Q62245 |
-実験情報
-実験
| 実験 | 手法:  溶液NMR 溶液NMR |
|---|---|
| NMR実験 | タイプ : SEE JOURNAL ARTICLE : SEE JOURNAL ARTICLE |
- 試料調製
試料調製
| 試料状態 | pH: 6.0 / 温度: 298. K |
|---|---|
結晶化 | *PLUS 手法: その他 / 詳細: NMR |
-NMR測定
| NMRスペクトロメーター | タイプ: Varian UNITYPLUS / 製造業者: Varian / モデル : UNITYPLUS / 磁場強度: 600 MHz : UNITYPLUS / 磁場強度: 600 MHz |
|---|
- 解析
解析
| ソフトウェア |
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| NMR software |
| |||||||||
| 精密化 | 手法: DG, SA / ソフトェア番号: 1 詳細: TWO ENSEMBLES WERE CALCULATED. BOTH USED THE SAME SET OF NOE/ANGLE/J-COUPLING RESTRAINTS, BUT THEY DIFFER IN THAT THE 2ND ENSEMBLE ALSO INCLUDED 1H AND 13C CHEMICAL SHIFTS AS RESTRAINTS (SEE ...詳細: TWO ENSEMBLES WERE CALCULATED. BOTH USED THE SAME SET OF NOE/ANGLE/J-COUPLING RESTRAINTS, BUT THEY DIFFER IN THAT THE 2ND ENSEMBLE ALSO INCLUDED 1H AND 13C CHEMICAL SHIFTS AS RESTRAINTS (SEE PRIMARY REFERENCE FOR DETAILS). RMSD BOND DISTANCES 0.009 +/- 0.0002 ANGSTROMS RMSD BOND ANGLE 2.70 +/- 0.08 DEGREES BACKBONE RMSD (N, CA, C, O) = 0.38 +/- 0.11 (SH3 DOMAIN RESIDUES 1 - 26, 36 - 54 AND SOS-E PEPTIDE RESIDUES 2 - 7) | |||||||||
| NMRアンサンブル | 計算したコンフォーマーの数: 200 / 登録したコンフォーマーの数: 15 |
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj











