[日本語] English
 万見
万見- EMDB-37385: The cryo-EM structure of human sphingomyelin synthase-related protein -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 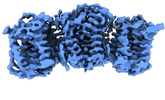 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The cryo-EM structure of human sphingomyelin synthase-related protein | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  synthase / synthase /  sphingomyelin (スフィンゴミエリン) / CPE / sphingomyelin (スフィンゴミエリン) / CPE /  membrane protein (膜タンパク質) / membrane protein (膜タンパク質) /  lipid metabolism (脂質代謝) lipid metabolism (脂質代謝) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ceramide phosphoethanolamine biosynthetic process /  ceramide phosphoethanolamine synthase activity / ceramide phosphoethanolamine synthase activity /  sphingomyelin synthase activity / sphingomyelin synthase activity /  ceramide cholinephosphotransferase activity / regulation of ceramide biosynthetic process / ceramide cholinephosphotransferase activity / regulation of ceramide biosynthetic process /  転移酵素; リンを含む基を移すもの; その他の、リン酸基を含む基を移すもの / sphingomyelin biosynthetic process / ceramide biosynthetic process / Sphingolipid de novo biosynthesis / endoplasmic reticulum membrane ...ceramide phosphoethanolamine biosynthetic process / 転移酵素; リンを含む基を移すもの; その他の、リン酸基を含む基を移すもの / sphingomyelin biosynthetic process / ceramide biosynthetic process / Sphingolipid de novo biosynthesis / endoplasmic reticulum membrane ...ceramide phosphoethanolamine biosynthetic process /  ceramide phosphoethanolamine synthase activity / ceramide phosphoethanolamine synthase activity /  sphingomyelin synthase activity / sphingomyelin synthase activity /  ceramide cholinephosphotransferase activity / regulation of ceramide biosynthetic process / ceramide cholinephosphotransferase activity / regulation of ceramide biosynthetic process /  転移酵素; リンを含む基を移すもの; その他の、リン酸基を含む基を移すもの / sphingomyelin biosynthetic process / ceramide biosynthetic process / Sphingolipid de novo biosynthesis / endoplasmic reticulum membrane / 転移酵素; リンを含む基を移すもの; その他の、リン酸基を含む基を移すもの / sphingomyelin biosynthetic process / ceramide biosynthetic process / Sphingolipid de novo biosynthesis / endoplasmic reticulum membrane /  小胞体 / 小胞体 /  生体膜 / 生体膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.5 Å クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Hu K / Zhang Q / Chen Y / Yao D / Zhou L / Cao Y | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2024 ジャーナル: Nat Struct Mol Biol / 年: 2024タイトル: Cryo-EM structure of human sphingomyelin synthase and its mechanistic implications for sphingomyelin synthesis. 著者: Kexin Hu / Qing Zhang / Yang Chen / Jintong Yang / Ying Xia / Bing Rao / Shaobai Li / Yafeng Shen / Mi Cao / Hongliang Lu / An Qin / Xian-Cheng Jiang / Deqiang Yao / Jie Zhao / Lu Zhou / Yu Cao /   要旨: Sphingomyelin (SM) has key roles in modulating mammalian membrane properties and serves as an important pool for bioactive molecules. SM biosynthesis is mediated by the sphingomyelin synthase (SMS) ...Sphingomyelin (SM) has key roles in modulating mammalian membrane properties and serves as an important pool for bioactive molecules. SM biosynthesis is mediated by the sphingomyelin synthase (SMS) family, comprising SMS1, SMS2 and SMS-related (SMSr) members. Although SMS1 and SMS2 exhibit SMS activity, SMSr possesses ceramide phosphoethanolamine synthase activity. Here we determined the cryo-electron microscopic structures of human SMSr in complexes with ceramide, diacylglycerol/phosphoethanolamine and ceramide/phosphoethanolamine (CPE). The structures revealed a hexameric arrangement with a reaction chamber located between the transmembrane helices. Within this structure, a catalytic pentad E-H/D-H-D was identified, situated at the interface between the lipophilic and hydrophilic segments of the reaction chamber. Additionally, the study unveiled the two-step synthesis process catalyzed by SMSr, involving PE-PLC (phosphatidylethanolamine-phospholipase C) hydrolysis and the subsequent transfer of the phosphoethanolamine moiety to ceramide. This research provides insights into the catalytic mechanism of SMSr and expands our understanding of sphingolipid metabolism. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37385.map.gz emd_37385.map.gz | 93.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37385-v30.xml emd-37385-v30.xml emd-37385.xml emd-37385.xml | 13.7 KB 13.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_37385_fsc.xml emd_37385_fsc.xml | 9.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_37385.png emd_37385.png | 103.8 KB | ||
| Filedesc metadata |  emd-37385.cif.gz emd-37385.cif.gz | 5.2 KB | ||
| その他 |  emd_37385_half_map_1.map.gz emd_37385_half_map_1.map.gz emd_37385_half_map_2.map.gz emd_37385_half_map_2.map.gz | 91.7 MB 91.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37385 http://ftp.pdbj.org/pub/emdb/structures/EMD-37385 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37385 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37385 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37385.map.gz / 形式: CCP4 / 大きさ: 98.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37385.map.gz / 形式: CCP4 / 大きさ: 98.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_37385_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_37385_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : The cryo-EM structure of human sphingomyelin synthase-related protein
| 全体 | 名称: The cryo-EM structure of human sphingomyelin synthase-related protein |
|---|---|
| 要素 |
|
-超分子 #1: The cryo-EM structure of human sphingomyelin synthase-related protein
| 超分子 | 名称: The cryo-EM structure of human sphingomyelin synthase-related protein タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Sphingomyelin synthase-related protein 1
| 分子 | 名称: Sphingomyelin synthase-related protein 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO / EC番号:  sphingomyelin synthase sphingomyelin synthase |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 31.056529 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: RLDPEYWKTI LSCIYVFIVF GFTSFIMVIV HERVPDMQTY PPLPDIFLDS VPRIPWAFAM TEVCGMILCY IWLLVLLLHK HRSILLRRL CSLMGTVFLL RCFTMFVTSL SVPGQHLQCT GKIYGSVWEK LHRAFAIWSG FGMTLTGVHT CGDYMFSGHT V VLTMLNFF ...文字列: RLDPEYWKTI LSCIYVFIVF GFTSFIMVIV HERVPDMQTY PPLPDIFLDS VPRIPWAFAM TEVCGMILCY IWLLVLLLHK HRSILLRRL CSLMGTVFLL RCFTMFVTSL SVPGQHLQCT GKIYGSVWEK LHRAFAIWSG FGMTLTGVHT CGDYMFSGHT V VLTMLNFF VTEYTPRSWN FLHTLSWVLN LFGIFFILAA HEHYSIDVFI AFYITTRLFL YYHTLANTRA YQQSRRARIW FP MFSFFEC NVNGTVPNEY CWPFSKP UniProtKB: Sphingomyelin synthase-related protein 1 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.6 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.6 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー




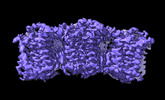

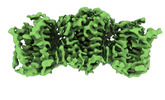



 Z
Z Y
Y X
X


















