+検索条件
-Structure paper
| タイトル | The missing part: the Archaeoglobus fulgidus Argonaute forms a functional heterodimer with an N-L1-L2 domain protein. |
|---|---|
| ジャーナル・号・ページ | Nucleic Acids Res, Vol. 52, Issue 5, Page 2530-2545, Year 2024 |
| 掲載日 | 2024年3月21日 |
 著者 著者 | Elena Manakova / Edvardas Golovinas / Reda Pocevičiūtė / Giedrius Sasnauskas / Arunas Silanskas / Danielis Rutkauskas / Marija Jankunec / Evelina Zagorskaitė / Edvinas Jurgelaitis / Algirdas Grybauskas / Česlovas Venclovas / Mindaugas Zaremba |
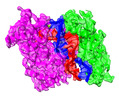
| PubMed 要旨 | Argonaute (Ago) proteins are present in all three domains of life (bacteria, archaea and eukaryotes). They use small (15-30 nucleotides) oligonucleotide guides to bind complementary nucleic acid ...Argonaute (Ago) proteins are present in all three domains of life (bacteria, archaea and eukaryotes). They use small (15-30 nucleotides) oligonucleotide guides to bind complementary nucleic acid targets and are responsible for gene expression regulation, mobile genome element silencing, and defence against viruses or plasmids. According to their domain organization, Agos are divided into long and short Agos. Long Agos found in prokaryotes (long-A and long-B pAgos) and eukaryotes (eAgos) comprise four major functional domains (N, PAZ, MID and PIWI) and two structural linker domains L1 and L2. The majority (∼60%) of pAgos are short pAgos, containing only the MID and inactive PIWI domains. Here we focus on the prokaryotic Argonaute AfAgo from Archaeoglobus fulgidus DSM4304. Although phylogenetically classified as a long-B pAgo, AfAgo contains only MID and catalytically inactive PIWI domains, akin to short pAgos. We show that AfAgo forms a heterodimeric complex with a protein encoded upstream in the same operon, which is a structural equivalent of the N-L1-L2 domains of long pAgos. This complex, structurally equivalent to a long PAZ-less pAgo, outperforms standalone AfAgo in guide RNA-mediated target DNA binding. Our findings provide a missing piece to one of the first and the most studied pAgos. |
 リンク リンク |  Nucleic Acids Res / Nucleic Acids Res /  PubMed:38197228 / PubMed:38197228 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) / X線回折 |
| 解像度 | 1.4 - 3.43 Å |
| 構造データ | EMDB-17973, PDB-8pvv: EMDB-18386, PDB-8qg0:  PDB-8ok9:  PDB-8old:  PDB-8olj: |
| 化合物 |  ChemComp-MG:  ChemComp-ACY:  ChemComp-EDO:  ChemComp-PEG:  ChemComp-HOH: 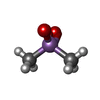 ChemComp-CAC:  ChemComp-CL:  ChemComp-MPD:  ChemComp-NA:  ChemComp-GOL:  ChemComp-IPA:  ChemComp-K:  ChemComp-TRS: |
| 由来 |
|
 キーワード キーワード |  RNA BINDING PROTEIN (RNA結合タンパク質) / Protein-nucleic acid interactions / RNA BINDING PROTEIN (RNA結合タンパク質) / Protein-nucleic acid interactions /  Argonaute (アルゴノート (タンパク質)) / pAgo / guide and target specificity / Argonaute (アルゴノート (タンパク質)) / pAgo / guide and target specificity /  PROTEIN BINDING (タンパク質) / PROTEIN BINDING (タンパク質) /  DNA BINDING PROTEIN (DNA結合タンパク質) / DNA BINDING PROTEIN (DNA結合タンパク質) /  PIWI DOMAIN / PIWI DOMAIN /  PROTEIN-DNA COMPLEX (デオキシリボ核酸) PROTEIN-DNA COMPLEX (デオキシリボ核酸) |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について