+検索条件
-Structure paper
| タイトル | Structures of human γδ T cell receptor-CD3 complex. |
|---|---|
| ジャーナル・号・ページ | Nature, Year 2024 |
| 掲載日 | 2024年4月24日 |
 著者 著者 | Weizhi Xin / Bangdong Huang / Ximin Chi / Yuehua Liu / Mengjiao Xu / Yuanyuan Zhang / Xu Li / Qiang Su / Qiang Zhou /  |
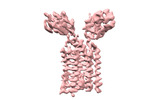
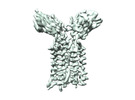
| PubMed 要旨 | Gamma delta (γδ) T cells, a unique T cell subgroup, are crucial in various immune responses and immunopathology. The γδ T cell receptor (TCR), which is generated by γδ T cells, recognizes a ...Gamma delta (γδ) T cells, a unique T cell subgroup, are crucial in various immune responses and immunopathology. The γδ T cell receptor (TCR), which is generated by γδ T cells, recognizes a diverse range of antigens independently of the major histocompatibility complex. The γδ TCR associates with CD3 subunits, initiating T cell activation and holding great potential in immunotherapy. Here we report the structures of two prototypical human Vγ9Vδ2 and Vγ5Vδ1 TCR-CD3 complexes, revealing two distinct assembly mechanisms that depend on Vγ usage. The Vγ9Vδ2 TCR-CD3 complex is monomeric, with considerable conformational flexibility in the TCRγ-TCRδ extracellular domain and connecting peptides. The length of the connecting peptides regulates the ligand association and T cell activation. A cholesterol-like molecule wedges into the transmembrane region, exerting an inhibitory role in TCR signalling. The Vγ5Vδ1 TCR-CD3 complex displays a dimeric architecture, whereby two protomers nestle back to back through the Vγ5 domains of the TCR extracellular domains. Our biochemical and biophysical assays further corroborate the dimeric structure. Importantly, the dimeric form of the Vγ5Vδ1 TCR is essential for T cell activation. These findings reveal organizing principles of the γδ TCR-CD3 complex, providing insights into the unique properties of γδ TCR and facilitating immunotherapeutic interventions. |
 リンク リンク |  Nature / Nature /  PubMed:38657677 PubMed:38657677 |
| 手法 | EM (単粒子) |
| 解像度 | 3.0 - 9.5 Å |
| 構造データ | EMDB-36147, PDB-8jbv: EMDB-36149, PDB-8jc0: 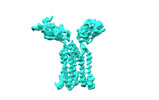 EMDB-36152: Vgamma5 Vdelta1 TCR complex (MPDI/TMDI) 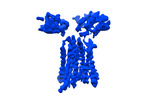 EMDB-36153: Vgamma5 Vdelta1 TCR complex (MPDII/TMDII)  EMDB-36155: Vgamma5 Vdelta1 TCR complex (MPD/TMD) EMDB-36156, PDB-8jcb: EMDB-37904, PDB-8wxe: EMDB-37914, PDB-8wy0: EMDB-37929, PDB-8wyi: EMDB-39128, PDB-8yc0:  EMDB-39359: T cell receptor V delta2 V gamma9 in GDN (DeepEMhancer) 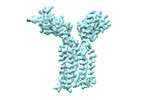 EMDB-39361: Vgamma5 Vdelta1 TCR complex (MPDI/TMDI, DeepEMhancer) 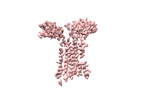 EMDB-39362: Vgamma5 Vdelta1 TCR complex (MPDII/TMDII, DeepEMhancer) 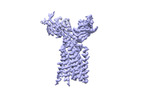 EMDB-39363: V gamma9 V delta2 TCR and CD3 complex in LMNG (DeepEMhancer) 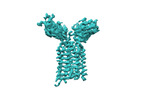 EMDB-39367: Vgamma5 Vdelta1 TCR-CD3 complex (EH mutant, DeepEMhancer)  EMDB-39368: Extracellular domain of Vgamma5 Vdelta1 TCR (DeepEMhancer) |
| 化合物 |  ChemComp-CLR: |
| 由来 |
|
 キーワード キーワード |  IMMUNE SYSTEM (免疫系) / Receptor / IMMUNE SYSTEM (免疫系) / Receptor /  immunity / immunity /  immune immune |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について