+検索条件
-Structure paper
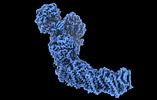
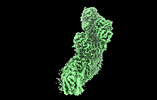
| タイトル | Structure of mycobacterial respiratory complex I. |
|---|---|
| ジャーナル・号・ページ | Proc Natl Acad Sci U S A, Vol. 120, Issue 13, Page e2214949120, Year 2023 |
| 掲載日 | 2023年3月28日 |
 著者 著者 | Yingke Liang / Alicia Plourde / Stephanie A Bueler / Jun Liu / Peter Brzezinski / Siavash Vahidi / John L Rubinstein /   |
| PubMed 要旨 | Oxidative phosphorylation, the combined activity of the electron transport chain (ETC) and adenosine triphosphate synthase, has emerged as a valuable target for the treatment of infection by and ...Oxidative phosphorylation, the combined activity of the electron transport chain (ETC) and adenosine triphosphate synthase, has emerged as a valuable target for the treatment of infection by and other mycobacteria. The mycobacterial ETC is highly branched with multiple dehydrogenases transferring electrons to a membrane-bound pool of menaquinone and multiple oxidases transferring electrons from the pool. The proton-pumping type I nicotinamide adenine dinucleotide (NADH) dehydrogenase (Complex I) is found in low abundance in the plasma membranes of mycobacteria in typical in vitro culture conditions and is often considered dispensable. We found that growth of in carbon-limited conditions greatly increased the abundance of Complex I and allowed isolation of a rotenone-sensitive preparation of the enzyme. Determination of the structure of the complex by cryoEM revealed the "orphan" two-component response regulator protein MSMEG_2064 as a subunit of the assembly. MSMEG_2064 in the complex occupies a site similar to the proposed redox-sensing subunit NDUFA9 in eukaryotic Complex I. An apparent purine nucleoside triphosphate within the NuoG subunit resembles the GTP-derived molybdenum cofactor in homologous formate dehydrogenase enzymes. The membrane region of the complex binds acyl phosphatidylinositol dimannoside, a characteristic three-tailed lipid from the mycobacterial membrane. The structure also shows menaquinone, which is preferentially used over ubiquinone by gram-positive bacteria, in two different positions along the quinone channel, comparable to ubiquinone in other structures and suggesting a conserved quinone binding mechanism. |
 リンク リンク |  Proc Natl Acad Sci U S A / Proc Natl Acad Sci U S A /  PubMed:36952383 / PubMed:36952383 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.6 - 2.8 Å |
| 構造データ | EMDB-27963, PDB-8e9g: EMDB-27964, PDB-8e9h: EMDB-27965, PDB-8e9i: |
| 化合物 |  ChemComp-SF4: 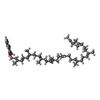 ChemComp-MQ9:  ChemComp-FES:  ChemComp-GTP:  ChemComp-ZN:  ChemComp-FMN:  ChemComp-XP2: |
| 由来 |
|
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  Complex / Complex /  Oxidative Phosphorylation (酸化的リン酸化) / Oxidative Phosphorylation (酸化的リン酸化) /  NADH-quinone oxidoreductase (NADHデヒドロゲナーゼ (キノン)) / NADH-quinone oxidoreductase (NADHデヒドロゲナーゼ (キノン)) /  Iron-sulfur Protein (鉄硫黄タンパク質) Iron-sulfur Protein (鉄硫黄タンパク質) |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について







 mycolicibacterium smegmatis mc2 155 (バクテリア)
mycolicibacterium smegmatis mc2 155 (バクテリア)