+検索条件
-Structure paper
| タイトル | Molecular dissection of the glutamine synthetase-GlnR nitrogen regulatory circuitry in Gram-positive bacteria. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 13, Issue 1, Page 3793, Year 2022 |
| 掲載日 | 2022年7月1日 |
 著者 著者 | Brady A Travis / Jared V Peck / Raul Salinas / Brandon Dopkins / Nicholas Lent / Viet D Nguyen / Mario J Borgnia / Richard G Brennan / Maria A Schumacher /  |
| PubMed 要旨 | How bacteria sense and respond to nitrogen levels are central questions in microbial physiology. In Gram-positive bacteria, nitrogen homeostasis is controlled by an operon encoding glutamine ...How bacteria sense and respond to nitrogen levels are central questions in microbial physiology. In Gram-positive bacteria, nitrogen homeostasis is controlled by an operon encoding glutamine synthetase (GS), a dodecameric machine that assimilates ammonium into glutamine, and the GlnR repressor. GlnR detects nitrogen excess indirectly by binding glutamine-feedback-inhibited-GS (FBI-GS), which activates its transcription-repression function. The molecular mechanisms behind this regulatory circuitry, however, are unknown. Here we describe biochemical and structural analyses of GS and FBI-GS-GlnR complexes from pathogenic and non-pathogenic Gram-positive bacteria. The structures show FBI-GS binds the GlnR C-terminal domain within its active-site cavity, juxtaposing two GlnR monomers to form a DNA-binding-competent GlnR dimer. The FBI-GS-GlnR interaction stabilizes the inactive GS conformation. Strikingly, this interaction also favors a remarkable dodecamer to tetradecamer transition in some GS, breaking the paradigm that all bacterial GS are dodecamers. These data thus unveil unique structural mechanisms of transcription and enzymatic regulation. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:35778410 / PubMed:35778410 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) / X線回折 |
| 解像度 | 1.96 - 3.5 Å |
| 構造データ | EMDB-25863, PDB-7tf6: EMDB-25864, PDB-7tf7: EMDB-25866, PDB-7tf9: EMDB-25867, PDB-7tfa: EMDB-25868, PDB-7tfb: EMDB-25869, PDB-7tfc: EMDB-25870, PDB-7tfd: EMDB-25871, PDB-7tfe:  PDB-7tdp:  PDB-7tdv:  PDB-7tea: 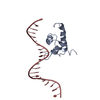 PDB-7tec:  PDB-7ten: |
| 化合物 |  ChemComp-ADP: 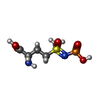 ChemComp-P3S:  ChemComp-MG:  ChemComp-HOH:  ChemComp-SO4:  ChemComp-CA: 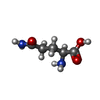 ChemComp-GLN: |
| 由来 |
|
 キーワード キーワード |  LIGASE (リガーゼ) / glutamate-ammonium ligase / GlnR / GS / LIGASE (リガーゼ) / glutamate-ammonium ligase / GlnR / GS /  feedback inhibition (酵素阻害剤) / feedback inhibition (酵素阻害剤) /  transcription coregulator / glnRA / transcription coregulator / glnRA /  Glutamine synthetase (グルタミンシンテターゼ) / S. aureus / femC / DNA BINDING PROTEIN/DNA / winged-HTH / transcription repressor / Glutamine synthetase (グルタミンシンテターゼ) / S. aureus / femC / DNA BINDING PROTEIN/DNA / winged-HTH / transcription repressor /  DNA BINDING PROTEIN (DNA結合タンパク質) / DNA BINDING PROTEIN-DNA complex / DNA BINDING PROTEIN (DNA結合タンパク質) / DNA BINDING PROTEIN-DNA complex /  listeria (リステリア) / listeria (リステリア) /  repressor (リプレッサー) / repressor (リプレッサー) /  transcription (転写 (生物学)) / LIGASE/INHIBITOR / glutamate ammonium ligase / Met-Sox / transcription (転写 (生物学)) / LIGASE/INHIBITOR / glutamate ammonium ligase / Met-Sox /  transition state (遷移状態) / LIGASE-INHIBITOR complex / transition state (遷移状態) / LIGASE-INHIBITOR complex /  BIOSYNTHETIC PROTEIN (生合成) / glutamine synthetase repressor dodecamer / glutamine synthetase dodecamer / glutamine synthetase repressor tetradecamer BIOSYNTHETIC PROTEIN (生合成) / glutamine synthetase repressor dodecamer / glutamine synthetase dodecamer / glutamine synthetase repressor tetradecamer |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について




















