+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human islet amyloid polypeptide (hIAPP) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Amyloid (アミロイド) / Amyloid (アミロイド) /  fibril (フィブリル) / PROTEIN FIBRIL fibril (フィブリル) / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption /  eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling / eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling /  Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly ...: / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption / Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly ...: / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption /  eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling / eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling /  Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly / positive regulation of cAMP-mediated signaling / positive regulation of calcium-mediated signaling / Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly / positive regulation of cAMP-mediated signaling / positive regulation of calcium-mediated signaling /  bone resorption / sensory perception of pain / osteoclast differentiation / bone resorption / sensory perception of pain / osteoclast differentiation /  hormone activity / cell-cell signaling / hormone activity / cell-cell signaling /  amyloid-beta binding / G alpha (s) signalling events / positive regulation of MAPK cascade / amyloid-beta binding / G alpha (s) signalling events / positive regulation of MAPK cascade /  receptor ligand activity / positive regulation of apoptotic process / Amyloid fiber formation / receptor ligand activity / positive regulation of apoptotic process / Amyloid fiber formation /  signaling receptor binding / apoptotic process / signaling receptor binding / apoptotic process /  lipid binding / lipid binding /  シグナル伝達 / シグナル伝達 /  extracellular space / extracellular region / identical protein binding extracellular space / extracellular region / identical protein binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
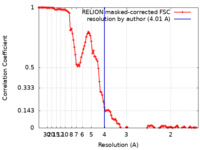
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.01 Å クライオ電子顕微鏡法 / 解像度: 4.01 Å | |||||||||
 データ登録者 データ登録者 | Ooi SA / Valli D / Maj M | |||||||||
| 資金援助 |  スウェーデン, 2件 スウェーデン, 2件
| |||||||||
 引用 引用 |  ジャーナル: Biophys J / 年: 2024 ジャーナル: Biophys J / 年: 2024タイトル: Improving cryo-EM grids for amyloid fibrils using interface-active solutions and spectator proteins. 著者: Dylan Valli / Saik Ann Ooi / Giorgio Scattolini / Himanshu Chaudhary / Alesia A Tietze / Michał Maj /  要旨: Preparation of cryoelectron microscopy (cryo-EM) grids for imaging of amyloid fibrils is notoriously challenging. The human islet amyloid polypeptide (hIAPP) serves as a notable example, as the ...Preparation of cryoelectron microscopy (cryo-EM) grids for imaging of amyloid fibrils is notoriously challenging. The human islet amyloid polypeptide (hIAPP) serves as a notable example, as the majority of reported structures have relied on the use of nonphysiological pH buffers, N-terminal tags, and seeding. This highlights the need for more efficient, reproducible methodologies that can elucidate amyloid fibril structures formed under diverse conditions. In this work, we demonstrate that the distribution of fibrils on cryo-EM grids is predominantly determined by the solution composition, which is critical for the stability of thin vitreous ice films. We discover that, among physiological pH buffers, HEPES uniquely enhances the distribution of fibrils on cryo-EM grids and improves the stability of ice layers. This improvement is attributed to direct interactions between HEPES molecules and hIAPP, effectively minimizing the tendency of hIAPP to form dense clusters in solutions and preventing ice nucleation. Furthermore, we provide additional support for the idea that denatured protein monolayers forming at the interface are also capable of eliciting a surfactant-like effect, leading to improved particle coverage. This phenomenon is illustrated by the addition of nonamyloidogenic rat IAPP (rIAPP) to a solution of preaggregated hIAPP just before the freezing process. The resultant grids, supplemented with this "spectator protein", exhibit notably enhanced coverage and improved ice quality. Unlike conventional surfactants, rIAPP is additionally capable of disentangling the dense clusters formed by hIAPP. By applying the proposed strategies, we have resolved the structure of the dominant hIAPP polymorph, formed in vitro at pH 7.4, to a final resolution of 4 Å. The advances in grid preparation presented in this work hold significant promise for enabling structural determination of amyloid proteins which are particularly resistant to conventional grid preparation techniques. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_18887.map.gz emd_18887.map.gz | 18.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-18887-v30.xml emd-18887-v30.xml emd-18887.xml emd-18887.xml | 13.1 KB 13.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_18887_fsc.xml emd_18887_fsc.xml | 11.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_18887.png emd_18887.png | 67.6 KB | ||
| Filedesc metadata |  emd-18887.cif.gz emd-18887.cif.gz | 4.7 KB | ||
| その他 |  emd_18887_half_map_1.map.gz emd_18887_half_map_1.map.gz emd_18887_half_map_2.map.gz emd_18887_half_map_2.map.gz | 98.3 MB 98.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-18887 http://ftp.pdbj.org/pub/emdb/structures/EMD-18887 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18887 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18887 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8r4iMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_18887.map.gz / 形式: CCP4 / 大きさ: 19.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_18887.map.gz / 形式: CCP4 / 大きさ: 19.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.828 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_18887_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_18887_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Islet amyloid polypeptide
| 全体 | 名称: Islet amyloid polypeptide アミリン (ホルモン) アミリン (ホルモン) |
|---|---|
| 要素 |
|
-超分子 #1: Islet amyloid polypeptide
| 超分子 | 名称: Islet amyloid polypeptide / タイプ: cell / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Islet amyloid polypeptide
| 分子 | 名称: Islet amyloid polypeptide / タイプ: protein_or_peptide / ID: 1 / コピー数: 10 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 3.907312 KDa |
| 配列 | 文字列: KCNTATCATQ RLANFLVHSS NNFGAILSST NVGSNTY(NH2) UniProtKB:  アミリン (ホルモン) アミリン (ホルモン) |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 1.7 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 105000 Bright-field microscopy / 最大 デフォーカス(公称値): 1.7 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 105000 |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 39.926 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー







 Z
Z Y
Y X
X