+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the Nup98(298-327) fibril | |||||||||
 マップデータ マップデータ | Post-processed and masked map. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Nup98 /  nuclear pore (核膜孔) / FG repeats / nuclear pore (核膜孔) / FG repeats /  amyloid fibrils (アミロイド) / PROTEIN FIBRIL amyloid fibrils (アミロイド) / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報telomere tethering at nuclear periphery / nuclear pore organization / nuclear pore outer ring /  nuclear pore complex assembly / post-transcriptional tethering of RNA polymerase II gene DNA at nuclear periphery / nuclear pore cytoplasmic filaments / Nuclear Pore Complex (NPC) Disassembly / nuclear inclusion body / nuclear pore nuclear basket / Transport of Ribonucleoproteins into the Host Nucleus ...telomere tethering at nuclear periphery / nuclear pore organization / nuclear pore outer ring / nuclear pore complex assembly / post-transcriptional tethering of RNA polymerase II gene DNA at nuclear periphery / nuclear pore cytoplasmic filaments / Nuclear Pore Complex (NPC) Disassembly / nuclear inclusion body / nuclear pore nuclear basket / Transport of Ribonucleoproteins into the Host Nucleus ...telomere tethering at nuclear periphery / nuclear pore organization / nuclear pore outer ring /  nuclear pore complex assembly / post-transcriptional tethering of RNA polymerase II gene DNA at nuclear periphery / nuclear pore cytoplasmic filaments / Nuclear Pore Complex (NPC) Disassembly / nuclear inclusion body / nuclear pore nuclear basket / Transport of Ribonucleoproteins into the Host Nucleus / Regulation of Glucokinase by Glucokinase Regulatory Protein / Defective TPR may confer susceptibility towards thyroid papillary carcinoma (TPC) / Transport of the SLBP independent Mature mRNA / Transport of the SLBP Dependant Mature mRNA / NS1 Mediated Effects on Host Pathways / SUMOylation of SUMOylation proteins / Transport of Mature mRNA Derived from an Intronless Transcript / structural constituent of nuclear pore / Rev-mediated nuclear export of HIV RNA / positive regulation of mRNA splicing, via spliceosome / SUMOylation of RNA binding proteins / Nuclear import of Rev protein / RNA export from nucleus / Transport of Mature mRNA derived from an Intron-Containing Transcript / NEP/NS2 Interacts with the Cellular Export Machinery / tRNA processing in the nucleus / Postmitotic nuclear pore complex (NPC) reformation / nucleocytoplasmic transport / Viral Messenger RNA Synthesis / nuclear pore complex assembly / post-transcriptional tethering of RNA polymerase II gene DNA at nuclear periphery / nuclear pore cytoplasmic filaments / Nuclear Pore Complex (NPC) Disassembly / nuclear inclusion body / nuclear pore nuclear basket / Transport of Ribonucleoproteins into the Host Nucleus / Regulation of Glucokinase by Glucokinase Regulatory Protein / Defective TPR may confer susceptibility towards thyroid papillary carcinoma (TPC) / Transport of the SLBP independent Mature mRNA / Transport of the SLBP Dependant Mature mRNA / NS1 Mediated Effects on Host Pathways / SUMOylation of SUMOylation proteins / Transport of Mature mRNA Derived from an Intronless Transcript / structural constituent of nuclear pore / Rev-mediated nuclear export of HIV RNA / positive regulation of mRNA splicing, via spliceosome / SUMOylation of RNA binding proteins / Nuclear import of Rev protein / RNA export from nucleus / Transport of Mature mRNA derived from an Intron-Containing Transcript / NEP/NS2 Interacts with the Cellular Export Machinery / tRNA processing in the nucleus / Postmitotic nuclear pore complex (NPC) reformation / nucleocytoplasmic transport / Viral Messenger RNA Synthesis /  nuclear localization sequence binding / SUMOylation of ubiquitinylation proteins / Vpr-mediated nuclear import of PICs / SUMOylation of DNA replication proteins / nuclear localization sequence binding / SUMOylation of ubiquitinylation proteins / Vpr-mediated nuclear import of PICs / SUMOylation of DNA replication proteins /  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / Regulation of HSF1-mediated heat shock response / mRNA transport / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / SUMOylation of DNA damage response and repair proteins / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / Regulation of HSF1-mediated heat shock response / mRNA transport / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / SUMOylation of DNA damage response and repair proteins /  核膜孔 / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Resolution of Sister Chromatid Cohesion / serine-type peptidase activity / SUMOylation of chromatin organization proteins / nuclear periphery / HCMV Late Events / RHO GTPases Activate Formins / promoter-specific chromatin binding / Transcriptional regulation by small RNAs / ISG15 antiviral mechanism / HCMV Early Events / protein import into nucleus / Separation of Sister Chromatids / 核膜孔 / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Resolution of Sister Chromatid Cohesion / serine-type peptidase activity / SUMOylation of chromatin organization proteins / nuclear periphery / HCMV Late Events / RHO GTPases Activate Formins / promoter-specific chromatin binding / Transcriptional regulation by small RNAs / ISG15 antiviral mechanism / HCMV Early Events / protein import into nucleus / Separation of Sister Chromatids /  核膜 / 核膜 /  snRNP Assembly / snRNP Assembly /  核膜 / 核膜 /  transcription coactivator activity / transcription coactivator activity /  nuclear body / nuclear body /  ribonucleoprotein complex / ribonucleoprotein complex /  mRNA binding / SARS-CoV-2 activates/modulates innate and adaptive immune responses / mRNA binding / SARS-CoV-2 activates/modulates innate and adaptive immune responses /  タンパク質分解 / タンパク質分解 /  RNA binding / RNA binding /  核質 / 核質 /  細胞質基質 細胞質基質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
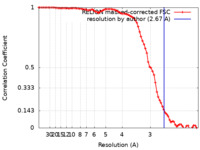
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.67 Å クライオ電子顕微鏡法 / 解像度: 2.67 Å | |||||||||
 データ登録者 データ登録者 | Ibanez de Opakua A / Cima-Omori S / Dienemann C / Zweckstetter M | |||||||||
| 資金援助 | European Union, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Impact of distinct FG nucleoporin repeats on Nup98 self-association. 著者: Alain Ibáñez de Opakua / Christian F Pantoja / Maria-Sol Cima-Omori / Christian Dienemann / Markus Zweckstetter /  要旨: Nucleoporins rich in phenylalanine/glycine (FG) residues form the permeability barrier within the nuclear pore complex and are implicated in several pathological cellular processes, including ...Nucleoporins rich in phenylalanine/glycine (FG) residues form the permeability barrier within the nuclear pore complex and are implicated in several pathological cellular processes, including oncogenic fusion condensates. The self-association of FG-repeat proteins and interactions between FG-repeats play a critical role in these activities by forming hydrogel-like structures. Here we show that mutation of specific FG repeats of Nup98 can strongly decrease the protein's self-association capabilities. We further present a cryo-electron microscopy structure of a Nup98 peptide fibril with higher stability per residue compared with previous Nup98 fibril structures. The high-resolution structure reveals zipper-like hydrophobic patches which contain a GLFG motif and are less compatible for binding to nuclear transport receptors. The identified distinct molecular properties of different regions of the nucleoporin may contribute to spatial variations in the self-association of FG-repeats, potentially influencing transport processes through the nuclear pore. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16671.map.gz emd_16671.map.gz | 2.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16671-v30.xml emd-16671-v30.xml emd-16671.xml emd-16671.xml | 14.1 KB 14.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16671_fsc.xml emd_16671_fsc.xml | 8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16671.png emd_16671.png | 118.6 KB | ||
| Filedesc metadata |  emd-16671.cif.gz emd-16671.cif.gz | 4.6 KB | ||
| その他 |  emd_16671_half_map_1.map.gz emd_16671_half_map_1.map.gz emd_16671_half_map_2.map.gz emd_16671_half_map_2.map.gz | 32.9 MB 32.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16671 http://ftp.pdbj.org/pub/emdb/structures/EMD-16671 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16671 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16671 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8ci8MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16671.map.gz / 形式: CCP4 / 大きさ: 42.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16671.map.gz / 形式: CCP4 / 大きさ: 42.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Post-processed and masked map. | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Relion refinement half map 2.
| ファイル | emd_16671_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Relion refinement half map 2. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Relion refinement half map 1.
| ファイル | emd_16671_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Relion refinement half map 1. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Nup98(298-327)
| 全体 | 名称: Nup98(298-327) |
|---|---|
| 要素 |
|
-超分子 #1: Nup98(298-327)
| 超分子 | 名称: Nup98(298-327) / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Synthetic peptide (N-terminal acetylated and C-terminal amydated). |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Nuclear pore complex protein Nup98
| 分子 | 名称: Nuclear pore complex protein Nup98 / タイプ: protein_or_peptide / ID: 1 / コピー数: 25 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 3.034271 KDa |
| 配列 | 文字列: TGFSFGNTST IGQPSTNTMG LFGVTQASQP UniProtKB:  Nuclear pore complex protein Nup98-Nup96 Nuclear pore complex protein Nup98-Nup96 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 6.5 / 詳細: In water. |
|---|---|
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm最小 デフォーカス(公称値): 0.7000000000000001 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均露光時間: 2.3 sec. / 平均電子線量: 40.62 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| ソフトウェア | 名称:  Coot Coot |
|---|---|
| 得られたモデル |  PDB-8ci8: |
 ムービー
ムービー コントローラー
コントローラー

























 Z
Z Y
Y X
X