+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | beta-2-microglobulin D76N amyloid fibril form 1PFa | ||||||||||||
 マップデータ マップデータ | CryoEM helical symmetrised map of b2m-D76N Form 1PFa (sharpening b-factor of -84) | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード |  Amyloid (アミロイド) / Amyloid (アミロイド) /  fibril (フィブリル) / helical / cross-beta / dialysis-related amyloidosis / b2m / polymorph / PROTEIN FIBRIL fibril (フィブリル) / helical / cross-beta / dialysis-related amyloidosis / b2m / polymorph / PROTEIN FIBRIL | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of ferrous iron binding / positive regulation of transferrin receptor binding / early endosome lumen / positive regulation of receptor binding / Nef mediated downregulation of MHC class I complex cell surface expression / DAP12 interactions / negative regulation of receptor binding / Endosomal/Vacuolar pathway / Antigen Presentation: Folding, assembly and peptide loading of class I MHC / antigen processing and presentation of exogenous protein antigen via MHC class Ib, TAP-dependent ...positive regulation of ferrous iron binding / positive regulation of transferrin receptor binding / early endosome lumen / positive regulation of receptor binding / Nef mediated downregulation of MHC class I complex cell surface expression / DAP12 interactions / negative regulation of receptor binding / Endosomal/Vacuolar pathway / Antigen Presentation: Folding, assembly and peptide loading of class I MHC / antigen processing and presentation of exogenous protein antigen via MHC class Ib, TAP-dependent / cellular response to iron(III) ion / negative regulation of forebrain neuron differentiation / ER to Golgi transport vesicle membrane / peptide antigen assembly with MHC class I protein complex / response to molecule of bacterial origin /  regulation of erythrocyte differentiation / regulation of iron ion transport / MHC class I peptide loading complex / HFE-transferrin receptor complex / T cell mediated cytotoxicity / cellular response to iron ion / antigen processing and presentation of endogenous peptide antigen via MHC class I / positive regulation of T cell cytokine production / MHC class I protein complex / multicellular organismal-level iron ion homeostasis / positive regulation of T cell mediated cytotoxicity / peptide antigen assembly with MHC class II protein complex / negative regulation of neurogenesis / MHC class II protein complex / positive regulation of receptor-mediated endocytosis / cellular response to nicotine / recycling endosome membrane / phagocytic vesicle membrane / specific granule lumen / peptide antigen binding / positive regulation of cellular senescence / antigen processing and presentation of exogenous peptide antigen via MHC class II / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell / Interferon gamma signaling / positive regulation of immune response / negative regulation of epithelial cell proliferation / Modulation by Mtb of host immune system / positive regulation of T cell activation / sensory perception of smell / negative regulation of neuron projection development / tertiary granule lumen / DAP12 signaling / MHC class II protein complex binding / late endosome membrane / T cell differentiation in thymus / positive regulation of protein binding / ER-Phagosome pathway / iron ion transport / protein refolding / early endosome membrane / protein homotetramerization / intracellular iron ion homeostasis / amyloid fibril formation / learning or memory / Amyloid fiber formation / lysosomal membrane / regulation of erythrocyte differentiation / regulation of iron ion transport / MHC class I peptide loading complex / HFE-transferrin receptor complex / T cell mediated cytotoxicity / cellular response to iron ion / antigen processing and presentation of endogenous peptide antigen via MHC class I / positive regulation of T cell cytokine production / MHC class I protein complex / multicellular organismal-level iron ion homeostasis / positive regulation of T cell mediated cytotoxicity / peptide antigen assembly with MHC class II protein complex / negative regulation of neurogenesis / MHC class II protein complex / positive regulation of receptor-mediated endocytosis / cellular response to nicotine / recycling endosome membrane / phagocytic vesicle membrane / specific granule lumen / peptide antigen binding / positive regulation of cellular senescence / antigen processing and presentation of exogenous peptide antigen via MHC class II / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell / Interferon gamma signaling / positive regulation of immune response / negative regulation of epithelial cell proliferation / Modulation by Mtb of host immune system / positive regulation of T cell activation / sensory perception of smell / negative regulation of neuron projection development / tertiary granule lumen / DAP12 signaling / MHC class II protein complex binding / late endosome membrane / T cell differentiation in thymus / positive regulation of protein binding / ER-Phagosome pathway / iron ion transport / protein refolding / early endosome membrane / protein homotetramerization / intracellular iron ion homeostasis / amyloid fibril formation / learning or memory / Amyloid fiber formation / lysosomal membrane /  小胞体 / external side of plasma membrane / 小胞体 / external side of plasma membrane /  ゴルジ体 / ゴルジ体 /  focal adhesion / Neutrophil degranulation / SARS-CoV-2 activates/modulates innate and adaptive immune responses / structural molecule activity / focal adhesion / Neutrophil degranulation / SARS-CoV-2 activates/modulates innate and adaptive immune responses / structural molecule activity /  ゴルジ体 / ゴルジ体 /  小胞体 / protein homodimerization activity / 小胞体 / protein homodimerization activity /  extracellular space / extracellular exosome / extracellular region / extracellular space / extracellular exosome / extracellular region /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞膜 / 細胞膜 /  細胞質基質 細胞質基質類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
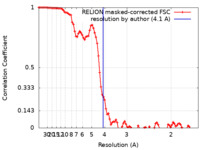
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.1 Å クライオ電子顕微鏡法 / 解像度: 4.1 Å | ||||||||||||
 データ登録者 データ登録者 | Wilkinson M / Gallardo R / Guthertz N / Martinez RM / Radford SE / Ranson NA | ||||||||||||
| 資金援助 |  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Disease-relevant β-microglobulin variants share a common amyloid fold. 著者: Martin Wilkinson / Rodrigo U Gallardo / Roberto Maya Martinez / Nicolas Guthertz / Masatomo So / Liam D Aubrey / Sheena E Radford / Neil A Ranson /    要旨: β-microglobulin (βm) and its truncated variant ΔΝ6 are co-deposited in amyloid fibrils in the joints, causing the disorder dialysis-related amyloidosis (DRA). Point mutations of βm result in ...β-microglobulin (βm) and its truncated variant ΔΝ6 are co-deposited in amyloid fibrils in the joints, causing the disorder dialysis-related amyloidosis (DRA). Point mutations of βm result in diseases with distinct pathologies. βm-D76N causes a rare systemic amyloidosis with protein deposited in the viscera in the absence of renal failure, whilst βm-V27M is associated with renal failure, with amyloid deposits forming predominantly in the tongue. Here we use cryoEM to determine the structures of fibrils formed from these variants under identical conditions in vitro. We show that each fibril sample is polymorphic, with diversity arising from a 'lego-like' assembly of a common amyloid building block. These results suggest a 'many sequences, one amyloid fold' paradigm in contrast with the recently reported 'one sequence, many amyloid folds' behaviour of intrinsically disordered proteins such as tau and Aβ. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15226.map.gz emd_15226.map.gz | 7.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15226-v30.xml emd-15226-v30.xml emd-15226.xml emd-15226.xml | 18.9 KB 18.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15226_fsc.xml emd_15226_fsc.xml | 9.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15226.png emd_15226.png | 70.8 KB | ||
| Filedesc metadata |  emd-15226.cif.gz emd-15226.cif.gz | 5.6 KB | ||
| その他 |  emd_15226_half_map_1.map.gz emd_15226_half_map_1.map.gz emd_15226_half_map_2.map.gz emd_15226_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15226 http://ftp.pdbj.org/pub/emdb/structures/EMD-15226 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15226 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15226 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15226.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15226.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM helical symmetrised map of b2m-D76N Form 1PFa (sharpening b-factor of -84) | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: halfmap2
| ファイル | emd_15226_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: halfmap1
| ファイル | emd_15226_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | halfmap1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Amyloid fibril polymorph 1PFa of the beta-2-microglobulin D76N va...
| 全体 | 名称: Amyloid fibril polymorph 1PFa of the beta-2-microglobulin D76N variant. |
|---|---|
| 要素 |
|
-超分子 #1: Amyloid fibril polymorph 1PFa of the beta-2-microglobulin D76N va...
| 超分子 | 名称: Amyloid fibril polymorph 1PFa of the beta-2-microglobulin D76N variant. タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Recombinantly expressed and fibrillated in vitro at pH 6.2 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: beta-2-microglobulin variant D76N
| 分子 | 名称: beta-2-microglobulin variant D76N / タイプ: protein_or_peptide / ID: 1 / 詳細: Natural b2m variant D76N / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Escherichia coli BL21 (大腸菌) Escherichia coli BL21 (大腸菌) |
| 配列 | 文字列: IQRTPKIQVY SRHPAENGKS NFLNCYVSGF HPSDIEVDLL KNGERIEKVE HSDLSFSKDW SFYLLYYTEF TPTEKNEYAC RVNHVTLSQP KIVKWDRDM UniProtKB:  Β2-ミクログロブリン Β2-ミクログロブリン |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 6.2 構成要素:
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: EMS Lacey Carbon / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: GRAPHENE OXIDE / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 60 sec. 詳細: The grid was plasma cleaned prior to 2x application of graphene oxide-DDM mixture, then grid was used immediately for sample application and vitrification | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: 6s blot. | |||||||||
| 詳細 | Fibrillation conditions: 40 uM monomeric b2m-D76N at 37C with shaking at 600 rpm for 2-3 weeks |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 96000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 96000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 3849 / 平均露光時間: 6.2 sec. / 平均電子線量: 43.0 e/Å2 詳細: 1477 raw EER frames were collected per image and combined into 54 fractions for processing |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)