+ データを開く
データを開く
- 基本情報
基本情報
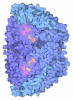
| 登録情報 | データベース: PDB / ID: 9qqt | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Methyl-coenzyme M reductase of ANME-2d Candidatus Methanoperedens Vercelli Strain 1 from a bioreactor enrichment culture | ||||||||||||||||||
 要素 要素 | (Methyl-coenzyme M reductase subunit ...) x 4 | ||||||||||||||||||
 キーワード キーワード | TRANSFERASE / methanotrophy / anaerobic methanotrophic archaea / methane oxidation / methyl-coenzyme M reductase / ANME / MCR / reverse methanogenesis / nickel-dependent enzyme / coenzyme M / coenzyme B / F430 cofactor / post-translational modification | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報coenzyme-B sulfoethylthiotransferase / coenzyme-B sulfoethylthiotransferase activity / methanogenesis / metal ion binding 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Candidatus Methanoperedens sp. (古細菌) Candidatus Methanoperedens sp. (古細菌) | ||||||||||||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 0.98 Å 分子置換 / 解像度: 0.98 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Mueller, M.-C. / Wagner, T. | ||||||||||||||||||
| 資金援助 | European Union,  ドイツ, ドイツ,  オランダ, 5件 オランダ, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Atomic resolution structures of the methane-activating enzyme in anaerobic methanotrophy reveal extensive post-translational modifications 著者: Mueller, M.-C. / Wissink, M. / Mukherjee, P. / von Possel, N. / Laso-Perez, R. / Engilberge, S. / Carpentier, P. / Kahnt, J. / Wegener, G. / Welte, C.U. / Wagner, T. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9qqt.cif.gz 9qqt.cif.gz | 1.5 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9qqt.ent.gz pdb9qqt.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  9qqt.json.gz 9qqt.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  9qqt_validation.pdf.gz 9qqt_validation.pdf.gz | 937.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  9qqt_full_validation.pdf.gz 9qqt_full_validation.pdf.gz | 931.7 KB | 表示 | |
| XML形式データ |  9qqt_validation.xml.gz 9qqt_validation.xml.gz | 140.7 KB | 表示 | |
| CIF形式データ |  9qqt_validation.cif.gz 9qqt_validation.cif.gz | 202.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qq/9qqt https://data.pdbj.org/pub/pdb/validation_reports/qq/9qqt ftp://data.pdbj.org/pub/pdb/validation_reports/qq/9qqt ftp://data.pdbj.org/pub/pdb/validation_reports/qq/9qqt | HTTPS FTP |
-関連構造データ
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
|---|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-Methyl-coenzyme M reductase subunit ... , 4種, 6分子 ABECFD
| #1: タンパク質 | 分子量: 61873.828 Da / 分子数: 1 / 由来タイプ: 天然 詳細: The subunit alpha contains six post-translational modifications: Methylhistidine 272, Methylarginine 286, Hydroxytryptophane 443, Thioglycine 461, Didehydroaspartate 466, and Methylcysteine 468 由来: (天然)  Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: / Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: /参照: UniProt: A0A822J3V5, coenzyme-B sulfoethylthiotransferase | ||||
|---|---|---|---|---|---|
| #2: タンパク質 | 分子量: 45334.617 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: / Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: /参照: UniProt: A0A822J4Y5, coenzyme-B sulfoethylthiotransferase #3: タンパク質 | 分子量: 28253.820 Da / 分子数: 2 / 由来タイプ: 天然 詳細: The subunit gamma contains a methylhistidine at position 159 由来: (天然)  Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: / / 参照: coenzyme-B sulfoethylthiotransferase Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: / / 参照: coenzyme-B sulfoethylthiotransferase#4: タンパク質 | | 分子量: 61857.828 Da / 分子数: 1 / 由来タイプ: 天然 詳細: The subunit alpha contains six post-translational modifications: Methylhistidine 272, Methylarginine 286, Hydroxytryptophane 443, Thioglycine 461, Didehydroaspartate 466, and Methylcysteine 468 由来: (天然)  Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: / Candidatus Methanoperedens sp. (古細菌) / 細胞株: / / 器官: / / Plasmid details: / / Variant: / / 株: Vercelli strain 1 / 組織: /参照: UniProt: A0A822J3V5, coenzyme-B sulfoethylthiotransferase |
-非ポリマー , 7種, 3324分子 
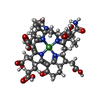








| #5: 化合物 | ChemComp-K / | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| #6: 化合物 | | #7: 化合物 | ChemComp-EDO / #8: 化合物 | #9: 化合物 | #10: 化合物 | #11: 水 | ChemComp-HOH / | |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.19 Å3/Da / 溶媒含有率: 43.88 % / 解説: Thick yellow brick-shaped |
|---|---|
| 結晶化 | 温度: 291.15 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 6.9 詳細: Crystals were produced on a Junior Clover plate using a crystallization solution containing 20 % w/v polyethylene glycol 3,350 and 200 mM sodium thiocyanate pH 6.9. The reservoir contained ...詳細: Crystals were produced on a Junior Clover plate using a crystallization solution containing 20 % w/v polyethylene glycol 3,350 and 200 mM sodium thiocyanate pH 6.9. The reservoir contained 100 ul crystallization solution and drops of 2 ul solution were mixed with 3 ul protein at a concentration of 40 mg/ml in 25 mM Tris/HCl pH 8.0, 10% v/v glycerol, 100 mM NaCl and 2 mM dithiothreitol. Crystals were soaked in the crystallization solution containing 20 % v/v ethylene glycol before freezing in liquid nitrogen. Temp details: / |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: BM07 / 波長: 0.9793 Å / ビームライン: BM07 / 波長: 0.9793 Å |
| 検出器 | タイプ: DECTRIS PILATUS 6M / 検出器: PIXEL / 日付: 2024年2月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.9793 Å / 相対比: 1 |
| 反射 | 解像度: 0.977→94.911 Å / Num. obs: 996827 / % possible obs: 83.9 % / 冗長度: 7.6 % / CC1/2: 0.998 / Rmerge(I) obs: 0.079 / Rpim(I) all: 0.03 / Rrim(I) all: 0.085 / Net I/σ(I): 13 |
| 反射 シェル | 解像度: 0.977→1.035 Å / 冗長度: 7 % / Rmerge(I) obs: 0.8 / Mean I/σ(I) obs: 1.9 / Num. unique obs: 49841 / CC1/2: 0.754 / Rpim(I) all: 0.32 / Rrim(I) all: 0.863 / % possible all: 62.6 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 / 解像度: 0.98→41.71 Å / SU ML: 0.08 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 16.7 / 立体化学のターゲット値: ML 分子置換 / 解像度: 0.98→41.71 Å / SU ML: 0.08 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 16.7 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.1 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 0.98→41.71 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj