[English] 日本語
 Yorodumi
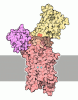
Yorodumi- PDB-9oc4: High-resolution cryo-EM structure of KdpFABC in the E1P-ADP state... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 9oc4 | ||||||
|---|---|---|---|---|---|---|---|
| Title | High-resolution cryo-EM structure of KdpFABC in the E1P-ADP state in lipid nanodisc | ||||||
 Components Components | (Potassium-transporting ATPase ...) x 4 | ||||||
 Keywords Keywords | TRANSPORT PROTEIN / P-type ATPase potassium channel transporter pump | ||||||
| Function / homology |  Function and homology information Function and homology informationP-type K+ transporter / P-type potassium transmembrane transporter activity / potassium:proton antiporter complex / potassium ion-transporting ATPase complex / monoatomic cation transmembrane transport / potassium ion binding / potassium ion transmembrane transport / potassium ion transport / magnesium ion binding / ATP hydrolysis activity ...P-type K+ transporter / P-type potassium transmembrane transporter activity / potassium:proton antiporter complex / potassium ion-transporting ATPase complex / monoatomic cation transmembrane transport / potassium ion binding / potassium ion transmembrane transport / potassium ion transport / magnesium ion binding / ATP hydrolysis activity / ATP binding / plasma membrane Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 2.1 Å | ||||||
 Authors Authors | Hussein, A.K. / Zhang, X. / Pedersen, B.P. / Stokes, D.L. | ||||||
| Funding support |  United States, 1items United States, 1items
| ||||||
 Citation Citation |  Journal: bioRxiv / Year: 2025 Journal: bioRxiv / Year: 2025Title: Conduction pathway for potassium through the E. coli pump KdpFABC. Authors: Adel Hussein / Xihui Zhang / Bjørn Panyella Pedersen / David L Stokes /   Abstract: Under osmotic stress, bacteria express a heterotetrameric protein complex, KdpFABC, which functions as an ATP-dependent K pump to maintain intracellular potassium levels. The subunit KdpA belongs to ...Under osmotic stress, bacteria express a heterotetrameric protein complex, KdpFABC, which functions as an ATP-dependent K pump to maintain intracellular potassium levels. The subunit KdpA belongs to the Superfamily of K Transporters and adopts a pseudo-tetrameric architecture with a membrane embedded selectivity filter as seen in K channels. KdpB belongs to the superfamily of P-type ATPases with a conserved binding site for ions within the membrane domain and three cytoplasmic domains that orchestrate ATP hydrolysis via an aspartyl phosphate intermediate. Previous work has hypothesized that K moves parallel to the membrane plane through a 40-Å long tunnel that connects the selectivity filter of KdpA with a canonical binding site in KdpB. In the current work, we have reconstituted KdpFABC into lipid nanodiscs and used cryo-EM to image the wild-type pump under turnover conditions. We present a 2.1 Å structure of the E1~P·ADP conformation, which reveals new features of the conduction pathway. This map shows strong densities within the selectivity filter and at the canonical binding site, consistent with K bound at each of these sites in this conformation. Many water molecules occupy a vestibule and the proximal end of the tunnel, which becomes markedly hydrophobic and dewetted at the subunit interface. We go on to use ATPase and ion transport assays to assess effects of numerous mutations along this proposed conduction pathway. The results confirm that K ions pass through the tunnel and support the existence of a low affinity site in KdpB for releasing these ions to the cytoplasm. Taken together, these data shed new light on the unique partnership between a transmembrane channel and an ATP-driven pump in maintaining the large electrochemical K gradient essential for bacterial survival. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  9oc4.cif.gz 9oc4.cif.gz | 288.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb9oc4.ent.gz pdb9oc4.ent.gz | 225.1 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  9oc4.json.gz 9oc4.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  9oc4_validation.pdf.gz 9oc4_validation.pdf.gz | 1.3 MB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  9oc4_full_validation.pdf.gz 9oc4_full_validation.pdf.gz | 1.3 MB | Display | |
| Data in XML |  9oc4_validation.xml.gz 9oc4_validation.xml.gz | 54.1 KB | Display | |
| Data in CIF |  9oc4_validation.cif.gz 9oc4_validation.cif.gz | 82.2 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/oc/9oc4 https://data.pdbj.org/pub/pdb/validation_reports/oc/9oc4 ftp://data.pdbj.org/pub/pdb/validation_reports/oc/9oc4 ftp://data.pdbj.org/pub/pdb/validation_reports/oc/9oc4 | HTTPS FTP |
-Related structure data
| Related structure data |  70308MC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
-Potassium-transporting ATPase ... , 4 types, 4 molecules ABCD
| #1: Protein | Mass: 59218.613 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
|---|---|
| #2: Protein | Mass: 72347.844 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
| #3: Protein | Mass: 22299.225 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
| #4: Protein/peptide | Mass: 3071.714 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
-Non-polymers , 5 types, 97 molecules 
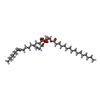







| #5: Chemical | | #6: Chemical | #7: Chemical | ChemComp-ADP / | #8: Chemical | #9: Water | ChemComp-HOH / | |
|---|
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: KdpFABC complex in the E1P-ADP state in lipid nanodisc Type: COMPLEX / Entity ID: #1-#4 / Source: RECOMBINANT | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Molecular weight | Value: 0.154150 MDa / Experimental value: NO | ||||||||||||||||||||
| Source (natural) | Organism:  | ||||||||||||||||||||
| Source (recombinant) | Organism:  | ||||||||||||||||||||
| Buffer solution | pH: 7.4 / Details: 20 mM Tris pH 7.4, 100 mM KCl, and 0.5 mM TCEP | ||||||||||||||||||||
| Buffer component |
| ||||||||||||||||||||
| Specimen | Conc.: 3.4 mg/ml / Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES | ||||||||||||||||||||
| Specimen support | Details: EasyGlow / Grid material: COPPER / Grid mesh size: 400 divisions/in. / Grid type: C-flat-1.2/1.3 | ||||||||||||||||||||
| Vitrification | Instrument: FEI VITROBOT MARK IV / Cryogen name: ETHANE / Humidity: 100 % / Chamber temperature: 277 K |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: TFS KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal magnification: 130000 X / Nominal defocus max: 2200 nm / Nominal defocus min: 700 nm / Cs: 2.7 mm / Alignment procedure: COMA FREE |
| Specimen holder | Cryogen: NITROGEN / Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER |
| Image recording | Electron dose: 50 e/Å2 / Film or detector model: FEI FALCON IV (4k x 4k) / Num. of grids imaged: 4 / Num. of real images: 50000 |
| EM imaging optics | Energyfilter name: TFS Selectris |
- Processing
Processing
| EM software |
| ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||
| Particle selection | Num. of particles selected: 10282000 | ||||||||||||||||||||||||||||||||||||||||||||
| Symmetry | Point symmetry: C1 (asymmetric) | ||||||||||||||||||||||||||||||||||||||||||||
| 3D reconstruction | Resolution: 2.1 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 672405 / Algorithm: FOURIER SPACE / Num. of class averages: 1 / Symmetry type: POINT | ||||||||||||||||||||||||||||||||||||||||||||
| Atomic model building | B value: 59.2 / Protocol: FLEXIBLE FIT / Space: REAL / Target criteria: cross-correlation | ||||||||||||||||||||||||||||||||||||||||||||
| Atomic model building | PDB-ID: 7LC3 Accession code: 7LC3 / Source name: PDB / Type: experimental model | ||||||||||||||||||||||||||||||||||||||||||||
| Refinement | Highest resolution: 2.1 Å Stereochemistry target values: REAL-SPACE (WEIGHTED MAP SUM AT ATOM CENTERS) | ||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
|
 Movie
Movie Controller
Controller


 PDBj
PDBj