+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8t14 | ||||||
|---|---|---|---|---|---|---|---|
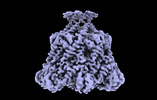
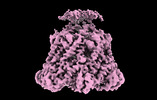
| タイトル | ADP-bound Bcs1 (C7 symmetrized) | ||||||
 要素 要素 | Mitochondrial chaperone BCS1 | ||||||
 キーワード キーワード | TRANSLOCASE / Heptamer / AAA-ATPase / ADP-bound | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報mitochondrial protein-transporting ATPase activity / protein insertion into mitochondrial inner membrane from matrix / mitochondrial cytochrome c oxidase assembly / mitochondrial respiratory chain complex III assembly / mitochondrial respiratory chain complex I assembly / mitochondrial inner membrane / ATP hydrolysis activity / mitochondrion / ATP binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.18 Å | ||||||
 データ登録者 データ登録者 | Zhan, J. / Xia, D. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Conformations of Bcs1L undergoing ATP hydrolysis suggest a concerted translocation mechanism for folded iron-sulfur protein substrate. 著者: Jingyu Zhan / Allison Zeher / Rick Huang / Wai Kwan Tang / Lisa M Jenkins / Di Xia /  要旨: The human AAA-ATPase Bcs1L translocates the fully assembled Rieske iron-sulfur protein (ISP) precursor across the mitochondrial inner membrane, enabling respiratory Complex III assembly. Exactly how ...The human AAA-ATPase Bcs1L translocates the fully assembled Rieske iron-sulfur protein (ISP) precursor across the mitochondrial inner membrane, enabling respiratory Complex III assembly. Exactly how the folded substrate is bound to and released from Bcs1L has been unclear, and there has been ongoing debate as to whether subunits of Bcs1L act in sequence or in unison hydrolyzing ATP when moving the protein cargo. Here, we captured Bcs1L conformations by cryo-EM during active ATP hydrolysis in the presence or absence of ISP substrate. In contrast to the threading mechanism widely employed by AAA proteins in substrate translocation, subunits of Bcs1L alternate uniformly between ATP and ADP conformations without detectable intermediates that have different, co-existing nucleotide states, indicating that the subunits act in concert. We further show that the ISP can be trapped by Bcs1 when its subunits are all in the ADP-bound state, which we propose to be released in the apo form. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8t14.cif.gz 8t14.cif.gz | 683 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8t14.ent.gz pdb8t14.ent.gz | 455.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8t14.json.gz 8t14.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8t14_validation.pdf.gz 8t14_validation.pdf.gz | 1.7 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8t14_full_validation.pdf.gz 8t14_full_validation.pdf.gz | 1.7 MB | 表示 | |
| XML形式データ |  8t14_validation.xml.gz 8t14_validation.xml.gz | 90 KB | 表示 | |
| CIF形式データ |  8t14_validation.cif.gz 8t14_validation.cif.gz | 128.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/t1/8t14 https://data.pdbj.org/pub/pdb/validation_reports/t1/8t14 ftp://data.pdbj.org/pub/pdb/validation_reports/t1/8t14 ftp://data.pdbj.org/pub/pdb/validation_reports/t1/8t14 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  40954MC  8t5uC  8t7uC  8tbyC  8ti0C  8tp1C  8tplC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域: Ens-ID: ens_1
|
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj

