+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8rq4 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-em structure of the rat Multidrug resistance-associated protein 2 (rMrp2) in complex with probenecid | ||||||
 要素 要素 | ATP-binding cassette sub-family C member 2 | ||||||
 キーワード キーワード | TRANSPORT PROTEIN / Multidrug resistance-associated protein 2 (rMrp2) in an autoinhibited state (nucleotide-free) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報mercury ion transport / benzylpenicillin metabolic process / Aspirin ADME / Paracetamol ADME / Atorvastatin ADME / canalicular bile acid transport / intracellular canaliculus / antibiotic metabolic process / bilirubin transmembrane transporter activity / bilirubin transport ...mercury ion transport / benzylpenicillin metabolic process / Aspirin ADME / Paracetamol ADME / Atorvastatin ADME / canalicular bile acid transport / intracellular canaliculus / antibiotic metabolic process / bilirubin transmembrane transporter activity / bilirubin transport / xenobiotic export from cell / Heme degradation / response to antineoplastic agent / leukotriene transport / thyroid hormone transport / prostaglandin transport / detoxification of mercury ion / ABC-family proteins mediated transport / regulation of bile acid secretion / ABC-type glutathione-S-conjugate transporter / ABC-type glutathione S-conjugate transporter activity / intracellular chloride ion homeostasis / organic anion transport / xenobiotic transmembrane transport / organic anion transmembrane transporter activity / xenobiotic transport across blood-brain barrier / transepithelial transport / xenobiotic detoxification by transmembrane export across the plasma membrane / intercellular canaliculus / ABC-type xenobiotic transporter / response to arsenic-containing substance / トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う / bile acid and bile salt transport / cellular response to interleukin-6 / ABC-type xenobiotic transporter activity / response to glucagon / response to steroid hormone / bile acid signaling pathway / xenobiotic transmembrane transporter activity / ATPase-coupled transmembrane transporter activity / cellular response to interleukin-1 / xenobiotic catabolic process / cellular response to dexamethasone stimulus / female pregnancy / brush border membrane / response to organic cyclic compound / transmembrane transport / response to estrogen / cellular response to xenobiotic stimulus / response to estradiol / cellular response to tumor necrosis factor / cellular response to lipopolysaccharide / response to oxidative stress / response to lipopolysaccharide / response to xenobiotic stimulus / apical plasma membrane / protein domain specific binding / negative regulation of gene expression / cell surface / ATP hydrolysis activity / ATP binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.45 Å | ||||||
 データ登録者 データ登録者 | Mazza, T. / Beis, K. | ||||||
| 資金援助 |  カナダ, 1件 カナダ, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural basis for the modulation of MRP2 activity by phosphorylation and drugs. 著者: Tiziano Mazza / Theodoros I Roumeliotis / Elena Garitta / David Drew / S Tamir Rashid / Cesare Indiveri / Jyoti S Choudhary / Kenneth J Linton / Konstantinos Beis /    要旨: Multidrug resistance-associated protein 2 (MRP2/ABCC2) is a polyspecific efflux transporter of organic anions expressed in hepatocyte canalicular membranes. MRP2 dysfunction, in Dubin-Johnson ...Multidrug resistance-associated protein 2 (MRP2/ABCC2) is a polyspecific efflux transporter of organic anions expressed in hepatocyte canalicular membranes. MRP2 dysfunction, in Dubin-Johnson syndrome or by off-target inhibition, for example by the uricosuric drug probenecid, elevates circulating bilirubin glucuronide and is a cause of jaundice. Here, we determine the cryo-EM structure of rat Mrp2 (rMrp2) in an autoinhibited state and in complex with probenecid. The autoinhibited state exhibits an unusual conformation for this class of transporter in which the regulatory domain is folded within the transmembrane domain cavity. In vitro phosphorylation, mass spectrometry and transport assays show that phosphorylation of the regulatory domain relieves this autoinhibition and enhances rMrp2 transport activity. The in vitro data is confirmed in human hepatocyte-like cells, in which inhibition of endogenous kinases also reduces human MRP2 transport activity. The drug-bound state reveals two probenecid binding sites that suggest a dynamic interplay with autoinhibition. Mapping of the Dubin-Johnson mutations onto the rodent structure indicates that many may interfere with the transition between conformational states. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8rq4.cif.gz 8rq4.cif.gz | 259.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8rq4.ent.gz pdb8rq4.ent.gz | 204.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8rq4.json.gz 8rq4.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8rq4_validation.pdf.gz 8rq4_validation.pdf.gz | 1.7 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8rq4_full_validation.pdf.gz 8rq4_full_validation.pdf.gz | 1.7 MB | 表示 | |
| XML形式データ |  8rq4_validation.xml.gz 8rq4_validation.xml.gz | 53.9 KB | 表示 | |
| CIF形式データ |  8rq4_validation.cif.gz 8rq4_validation.cif.gz | 77.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/rq/8rq4 https://data.pdbj.org/pub/pdb/validation_reports/rq/8rq4 ftp://data.pdbj.org/pub/pdb/validation_reports/rq/8rq4 ftp://data.pdbj.org/pub/pdb/validation_reports/rq/8rq4 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  19433MC  8rq3C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 173571.578 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   参照: UniProt: Q63120, トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う, ABC-type xenobiotic transporter, ABC-type glutathione-S-conjugate transporter | ||
|---|---|---|---|
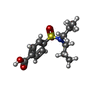
| #2: 化合物 | ChemComp-Y01 / | ||
| #3: 化合物 | | 研究の焦点であるリガンドがあるか | Y | |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Cryo-em structure of the rat Multidrug resistance-associated protein 2 (rMrp2) in complex with probenecid タイプ: ORGANELLE OR CELLULAR COMPONENT / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 1200 nm |
| 撮影 | 電子線照射量: 52.8 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3次元再構成 | 解像度: 3.45 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 247763 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: AB INITIO MODEL | ||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 8RQ3 PDB chain-ID: A / Accession code: 8RQ3 / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj