+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8pu0 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human Elp123 in complex with tRNA, desulpho-CoA, 5'-deoxyadenosine and methionine | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSLATION / Elongator / tRNA modification / acetyl-CoA hydrolysis | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報phosphorylase kinase regulator activity / tRNA uridine(34) acetyltransferase activity / tRNA carboxymethyluridine synthase / elongator holoenzyme complex / tRNA wobble base 5-methoxycarbonylmethyl-2-thiouridinylation / tRNA wobble uridine modification / regulation of receptor signaling pathway via JAK-STAT / acetyltransferase activity / central nervous system development / transcription elongation factor complex ...phosphorylase kinase regulator activity / tRNA uridine(34) acetyltransferase activity / tRNA carboxymethyluridine synthase / elongator holoenzyme complex / tRNA wobble base 5-methoxycarbonylmethyl-2-thiouridinylation / tRNA wobble uridine modification / regulation of receptor signaling pathway via JAK-STAT / acetyltransferase activity / central nervous system development / transcription elongation factor complex / transcription elongation by RNA polymerase II / neuron migration / regulation of translation / HATs acetylate histones / 4 iron, 4 sulfur cluster binding / tRNA binding / positive regulation of cell migration / regulation of transcription by RNA polymerase II / protein kinase binding / nucleolus / nucleoplasm / metal ion binding / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.25 Å | ||||||
 データ登録者 データ登録者 | Abbassi, N. / Jaciuk, M. / Lin, T.-Y. / Glatt, S. | ||||||
| 資金援助 | European Union, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Cryo-EM structures of the human Elongator complex at work. 著者: Nour-El-Hana Abbassi / Marcin Jaciuk / David Scherf / Pauline Böhnert / Alexander Rau / Alexander Hammermeister / Michał Rawski / Paulina Indyka / Grzegorz Wazny / Andrzej Chramiec-Głąbik ...著者: Nour-El-Hana Abbassi / Marcin Jaciuk / David Scherf / Pauline Böhnert / Alexander Rau / Alexander Hammermeister / Michał Rawski / Paulina Indyka / Grzegorz Wazny / Andrzej Chramiec-Głąbik / Dominika Dobosz / Bozena Skupien-Rabian / Urszula Jankowska / Juri Rappsilber / Raffael Schaffrath / Ting-Yu Lin / Sebastian Glatt /    要旨: tRNA modifications affect ribosomal elongation speed and co-translational folding dynamics. The Elongator complex is responsible for introducing 5-carboxymethyl at wobble uridine bases (cmU) in ...tRNA modifications affect ribosomal elongation speed and co-translational folding dynamics. The Elongator complex is responsible for introducing 5-carboxymethyl at wobble uridine bases (cmU) in eukaryotic tRNAs. However, the structure and function of human Elongator remain poorly understood. In this study, we present a series of cryo-EM structures of human ELP123 in complex with tRNA and cofactors at four different stages of the reaction. The structures at resolutions of up to 2.9 Å together with complementary functional analyses reveal the molecular mechanism of the modification reaction. Our results show that tRNA binding exposes a universally conserved uridine at position 33 (U), which triggers acetyl-CoA hydrolysis. We identify a series of conserved residues that are crucial for the radical-based acetylation of U and profile the molecular effects of patient-derived mutations. Together, we provide the high-resolution view of human Elongator and reveal its detailed mechanism of action. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8pu0.cif.gz 8pu0.cif.gz | 534.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8pu0.ent.gz pdb8pu0.ent.gz | 411.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8pu0.json.gz 8pu0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8pu0_validation.pdf.gz 8pu0_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8pu0_full_validation.pdf.gz 8pu0_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  8pu0_validation.xml.gz 8pu0_validation.xml.gz | 100.1 KB | 表示 | |
| CIF形式データ |  8pu0_validation.cif.gz 8pu0_validation.cif.gz | 150.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pu/8pu0 https://data.pdbj.org/pub/pdb/validation_reports/pu/8pu0 ftp://data.pdbj.org/pub/pdb/validation_reports/pu/8pu0 ftp://data.pdbj.org/pub/pdb/validation_reports/pu/8pu0 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Elongator complex protein ... , 3種, 4分子 AEBC
| #1: タンパク質 | 分子量: 150427.484 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ELP1, IKAP, IKBKAP Homo sapiens (ヒト) / 遺伝子: ELP1, IKAP, IKBKAP発現宿主:  参照: UniProt: O95163 #2: タンパク質 | | 分子量: 92597.766 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ELP2, STATIP1 Homo sapiens (ヒト) / 遺伝子: ELP2, STATIP1発現宿主:  参照: UniProt: Q6IA86 #3: タンパク質 | | 分子量: 65740.539 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ELP3 Homo sapiens (ヒト) / 遺伝子: ELP3発現宿主:  参照: UniProt: Q9H9T3, 転移酵素; アシル基を移すもの; アミノアシル基以外のアシル基を移すもの |
|---|
-RNA鎖 , 1種, 1分子 X
| #4: RNA鎖 | 分子量: 24047.236 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
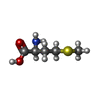
-非ポリマー , 4種, 4分子 





| #5: 化合物 | ChemComp-DCA / |
|---|---|
| #6: 化合物 | ChemComp-SF4 / |
| #7: 化合物 | ChemComp-5AD / |
| #8: 化合物 | ChemComp-MET / |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Human Elp123 in complex with glutamine tRNA, desulpho-CoA, 5'-deoxyadenosine and methionine タイプ: COMPLEX / Entity ID: #1-#4 / 由来: RECOMBINANT | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.635 MDa / 実験値: NO | |||||||||||||||||||||||||
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  | |||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | |||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||
| 試料 | 濃度: 0.6 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||||||
| 試料支持 | 詳細: 8 mA / グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: Quantifoil R2/1 | |||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K / 詳細: 15 s wait time, blot force 5, 5 s blot time |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 2100 nm / 最小 デフォーカス(公称値): 900 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 41.22 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 20720 |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV |
| 画像スキャン | 横: 5760 / 縦: 4092 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 画像処理 | 詳細: 20 eV slit, fully tuned before the experiment | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 4.25 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 115026 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | 詳細: Elp123-tRNA-ACO structure from the same study / Source name: Other / タイプ: in silico model | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj


































