+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8pbb | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
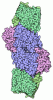
| タイトル | CHAPSO treated partial catalytic component (comprising only AnfD & AnfK, lacking AnfG and FeFeco) of iron nitrogenase from Rhodobacter capsulatus | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | OXIDOREDUCTASE / nitrogen fixation / Fe nitrogenase | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報nitrogenase / nitrogenase activity / nitrogen fixation / iron-sulfur cluster binding / ATP binding / metal ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Rhodobacter capsulatus SB 1003 (バクテリア) Rhodobacter capsulatus SB 1003 (バクテリア) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.49 Å | |||||||||
 データ登録者 データ登録者 | Schmidt, F.V. / Schulz, L. / Zarzycki, J. / Prinz, S. / Erb, T.J. / Rebelein, J.G. | |||||||||
| 資金援助 |  ドイツ, 2件 ドイツ, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2024 ジャーナル: Nat Struct Mol Biol / 年: 2024タイトル: Structural insights into the iron nitrogenase complex. 著者: Frederik V Schmidt / Luca Schulz / Jan Zarzycki / Simone Prinz / Niels N Oehlmann / Tobias J Erb / Johannes G Rebelein /  要旨: Nitrogenases are best known for catalyzing the reduction of dinitrogen to ammonia at a complex metallic cofactor. Recently, nitrogenases were shown to reduce carbon dioxide (CO) and carbon monoxide ...Nitrogenases are best known for catalyzing the reduction of dinitrogen to ammonia at a complex metallic cofactor. Recently, nitrogenases were shown to reduce carbon dioxide (CO) and carbon monoxide to hydrocarbons, offering a pathway to recycle carbon waste into hydrocarbon products. Among the three nitrogenase isozymes, the iron nitrogenase has the highest wild-type activity for the reduction of CO, but the molecular architecture facilitating these activities has remained unknown. Here, we report a 2.35-Å cryogenic electron microscopy structure of the ADP·AlF-stabilized iron nitrogenase complex from Rhodobacter capsulatus, revealing an [FeSC-(R)-homocitrate] cluster in the active site. The enzyme complex suggests that the iron nitrogenase G subunit is involved in cluster stabilization and substrate channeling and confers specificity between nitrogenase reductase and catalytic component proteins. Moreover, the structure highlights a different interface between the two catalytic halves of the iron and the molybdenum nitrogenase, potentially influencing the intrasubunit 'communication' and thus the nitrogenase mechanism. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8pbb.cif.gz 8pbb.cif.gz | 303.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8pbb.ent.gz pdb8pbb.ent.gz | 241.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8pbb.json.gz 8pbb.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8pbb_validation.pdf.gz 8pbb_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8pbb_full_validation.pdf.gz 8pbb_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  8pbb_validation.xml.gz 8pbb_validation.xml.gz | 58.9 KB | 表示 | |
| CIF形式データ |  8pbb_validation.cif.gz 8pbb_validation.cif.gz | 89.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pb/8pbb https://data.pdbj.org/pub/pdb/validation_reports/pb/8pbb ftp://data.pdbj.org/pub/pdb/validation_reports/pb/8pbb ftp://data.pdbj.org/pub/pdb/validation_reports/pb/8pbb | HTTPS FTP |
-関連構造データ
| 関連構造データ |  17583MC  8oieC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 60221.117 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  Rhodobacter capsulatus SB 1003 (バクテリア) Rhodobacter capsulatus SB 1003 (バクテリア)遺伝子: anfD 発現宿主:  Rhodobacter capsulatus SB 1003 (バクテリア) Rhodobacter capsulatus SB 1003 (バクテリア)参照: UniProt: D5ANJ7 #2: タンパク質 | 分子量: 50776.398 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  Rhodobacter capsulatus SB 1003 (バクテリア) Rhodobacter capsulatus SB 1003 (バクテリア)遺伝子: anfK, RCAP_rcc00588 発現宿主:  Rhodobacter capsulatus SB 1003 (バクテリア) Rhodobacter capsulatus SB 1003 (バクテリア)参照: UniProt: D5ANJ9, nitrogenase #3: 化合物 | 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: CHAPSO treated partial catalytic component (comprising only AnfD & AnfK, lacking AnfG and FeFeco) of iron nitrogenase from Rhodobacter capsulatus タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Rhodobacter capsulatus SB 1003 (バクテリア) Rhodobacter capsulatus SB 1003 (バクテリア) |
| 由来(組換発現) | 生物種:  Rhodobacter capsulatus SB 1003 (バクテリア) Rhodobacter capsulatus SB 1003 (バクテリア) |
| 緩衝液 | pH: 7.8 詳細: 37.5 mM TRIS (pH = 7.8) 150 mM NaCl 3.75 mM sodium dithionite 0.4 % (m/V) CHAPSO |
| 試料 | 濃度: 0.75 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R2/1 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE-PROPANE / 湿度: 90 % / 凍結前の試料温度: 281 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 1400 nm / Cs: 2.7 mm |
| 撮影 | 電子線照射量: 50 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 7962489 | ||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C2 (2回回転対称) | ||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.49 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 927406 / クラス平均像の数: 7 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj