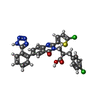
登録情報 データベース : PDB / ID : 8gydタイトル Structure of Schistosoma japonicum Glutathione S-transferase bound with the ligand complex of 16 Glutathione S-transferase class-mu 26 kDa isozyme キーワード / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Schistosoma japonicum (にほんじゅうけつきゅうちゅう)手法 / / / 解像度 : 1.7 Å データ登録者 Wen, X. / Jin, R. / Hu, H. / Zhu, J. / Song, W. / Lu, X. 資金援助 組織 認可番号 国 National Natural Science Foundation of China (NSFC) 91953203 National Natural Science Foundation of China (NSFC) 21877117 National Natural Science Foundation of China (NSFC) 82173831 National Natural Science Foundation of China (NSFC) 21907105 Shanghai Pujiang Program 2019PJD056 Science and Technology Commission of Shanghai Municipality 21ZR1475000 Shanghai Municipal Science and Technology Major Project
ジャーナル : J.Med.Chem. / 年 : 2023タイトル : Discovery, SAR Study of GST Inhibitors from a Novel Quinazolin-4(1 H )-one Focused DNA-Encoded Library.著者 : Wen, X. / Zhang, M. / Duan, Z. / Suo, Y. / Lu, W. / Jin, R. / Mu, B. / Li, K. / Zhang, X. / Meng, L. / Hong, Y. / Wang, X. / Hu, H. / Zhu, J. / Song, W. / Shen, A. / Lu, X. 履歴 登録 2022年9月22日 登録サイト / 処理サイト 改定 1.0 2023年8月23日 Provider / タイプ 改定 1.1 2023年9月6日 Group / カテゴリ / citation_authorItem _citation.journal_volume / _citation.page_first ... _citation.journal_volume / _citation.page_first / _citation.page_last / _citation_author.identifier_ORCID 改定 1.2 2023年9月13日 Group / カテゴリ / Item
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.7 Å
分子置換 / 解像度: 1.7 Å  データ登録者
データ登録者 中国, 7件
中国, 7件  引用
引用 ジャーナル: J.Med.Chem. / 年: 2023
ジャーナル: J.Med.Chem. / 年: 2023 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 8gyd.cif.gz
8gyd.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb8gyd.ent.gz
pdb8gyd.ent.gz PDB形式
PDB形式 8gyd.json.gz
8gyd.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 8gyd_validation.pdf.gz
8gyd_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 8gyd_full_validation.pdf.gz
8gyd_full_validation.pdf.gz 8gyd_validation.xml.gz
8gyd_validation.xml.gz 8gyd_validation.cif.gz
8gyd_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/gy/8gyd
https://data.pdbj.org/pub/pdb/validation_reports/gy/8gyd ftp://data.pdbj.org/pub/pdb/validation_reports/gy/8gyd
ftp://data.pdbj.org/pub/pdb/validation_reports/gy/8gyd
 F&H 検索
F&H 検索 リンク
リンク 集合体
集合体
 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I03 / 波長: 0.976 Å
/ ビームライン: I03 / 波長: 0.976 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj