+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8f5w | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Dihydropyrimidine Dehydrogenase (DPD) C671S Mutant Soaked with Dihydrothymine and NADPH Quasi-Anaerobically | |||||||||
 要素 要素 | Dihydropyrimidine dehydrogenase [NADP(+)] | |||||||||
 キーワード キーワード | FLAVOPROTEIN / Dihydropyrimidine dehydrogenase / protein / mutant / dihyrdothymine / NADPH | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報dihydropyrimidine dehydrogenase (NADP+) / uracil binding / thymidine catabolic process / dihydropyrimidine dehydrogenase (NADP+) activity / beta-alanine biosynthetic process / uracil catabolic process / thymine catabolic process / FMN binding / flavin adenine dinucleotide binding / NADP binding ...dihydropyrimidine dehydrogenase (NADP+) / uracil binding / thymidine catabolic process / dihydropyrimidine dehydrogenase (NADP+) activity / beta-alanine biosynthetic process / uracil catabolic process / thymine catabolic process / FMN binding / flavin adenine dinucleotide binding / NADP binding / 4 iron, 4 sulfur cluster binding / protein homodimerization activity / metal ion binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.97 Å 分子置換 / 解像度: 1.97 Å | |||||||||
 データ登録者 データ登録者 | Kaley, N. / Smith, M. / Forouzesh, D. / Liu, D. / Moran, G. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Arch.Biochem.Biophys. / 年: 2023 ジャーナル: Arch.Biochem.Biophys. / 年: 2023タイトル: Mammalian dihydropyrimidine dehydrogenase: Added mechanistic details from transient-state analysis of charge transfer complexes. 著者: Smith, M.M. / Forouzesh, D.C. / Kaley, N.E. / Liu, D. / Moran, G.R. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8f5w.cif.gz 8f5w.cif.gz | 808.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8f5w.ent.gz pdb8f5w.ent.gz | 650.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8f5w.json.gz 8f5w.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8f5w_validation.pdf.gz 8f5w_validation.pdf.gz | 11.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8f5w_full_validation.pdf.gz 8f5w_full_validation.pdf.gz | 11.6 MB | 表示 | |
| XML形式データ |  8f5w_validation.xml.gz 8f5w_validation.xml.gz | 172 KB | 表示 | |
| CIF形式データ |  8f5w_validation.cif.gz 8f5w_validation.cif.gz | 224.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/f5/8f5w https://data.pdbj.org/pub/pdb/validation_reports/f5/8f5w ftp://data.pdbj.org/pub/pdb/validation_reports/f5/8f5w ftp://data.pdbj.org/pub/pdb/validation_reports/f5/8f5w | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8f61C  8f6nC  7m31S S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 4分子 ABCD
| #1: タンパク質 | 分子量: 111587.281 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   参照: UniProt: Q28943, dihydropyrimidine dehydrogenase (NADP+) |
|---|
-非ポリマー , 6種, 1009分子 



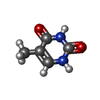






| #2: 化合物 | ChemComp-SF4 / #3: 化合物 | ChemComp-FAD / #4: 化合物 | ChemComp-NAP / #5: 化合物 | ChemComp-FNR / #6: 化合物 | ChemComp-TDR / #7: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | N |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.34 Å3/Da / 溶媒含有率: 47.4 % 解説: Crystals grew as single elongated rectangular hexahedrons (200 x 50 x 50 uM). |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 詳細: DPD variant C671S (39.2 uM) in 25 mM HEPES, 2 mM DTT, 10% glycerol at pH 7.5 was mixed 1:1 with well solution containing 100 mM sodium citrate, 2 mM DTT, 19% PEG 6000 at pH 4.7 to yield a 6 ...詳細: DPD variant C671S (39.2 uM) in 25 mM HEPES, 2 mM DTT, 10% glycerol at pH 7.5 was mixed 1:1 with well solution containing 100 mM sodium citrate, 2 mM DTT, 19% PEG 6000 at pH 4.7 to yield a 6 uL drop. Crystallization was carried out in the dark to prevent photo-degradation of the somewhat dissociable FMN cofactor. Under these conditions DPD crystals appeared within 16 hours and were left to grow for additional 24 hours. Ligands were combined with the crystals under near anaerobic conditions as follows: before being placed in a Plas-Labs 830 series glove box, the well solution beneath selected crystallization drops were made anaerobic with the addition of 10 mM dithionite and resealed with the cover slide. Crystals trays were placed in the glove box that contained a Motic binocular microscope coupled to an Accuscope 1080p high-definition camera. The glove box was sealed and made quasi-anaerobic by flushing with high-purity nitrogen gas for approximately 10 minutes at which time fractional dioxygen was recorded as 0.1 %, by a Forensics Detectors oxygen meter. Atmospheric dioxygen was measured throughout the soaking procedure and was held <1%. C671S DPD crystals were soaked for a minimum of 20 minutes with DHT (R,S) (200 uM) and NADPH (100 uM), each dissolved in the following cryo-solution: 20 mM sodium citrate, 0.4 mM DTT, 20% PEG 6000, 20% PEG 400, pH 7.5. The crystals were then submerged in liquid nitrogen, removed from the anaerobic environment, and stored under liquid nitrogen. |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  APS APS  / ビームライン: 21-ID-D / 波長: 1.1272 Å / ビームライン: 21-ID-D / 波長: 1.1272 Å | |||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS EIGER X 9M / 検出器: PIXEL / 日付: 2022年6月8日 | |||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||
| 放射波長 | 波長: 1.1272 Å / 相対比: 1 | |||||||||||||||||||||||||||
| 反射 | 解像度: 1.97→47.23 Å / Num. obs: 283435 / % possible obs: 98.6 % / 冗長度: 4 % / Biso Wilson estimate: 26.48 Å2 / CC1/2: 0.994 / Rmerge(I) obs: 0.1301 / Rpim(I) all: 0.075 / Rrim(I) all: 0.151 / Net I/σ(I): 10 | |||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
-位相決定
| 位相決定 | 手法:  分子置換 分子置換 |
|---|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 7M31 解像度: 1.97→47.23 Å / SU ML: 0.22 / 交差検証法: THROUGHOUT / σ(F): 1.35 / 位相誤差: 21.12 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.1 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 103.07 Å2 / Biso mean: 32.5455 Å2 / Biso min: 14.79 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.97→47.23 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 30
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj














