+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7ytj | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of VTC complex | |||||||||||||||||||||||||||||||||
 要素 要素 | (Vacuolar transporter chaperone ...) x 3 | |||||||||||||||||||||||||||||||||
 キーワード キーワード | TRANSPORT PROTEIN / VTC complex / Poly P. | |||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報vacuolar transporter chaperone complex / ATP-polyphosphate phosphotransferase / polyphosphate biosynthetic process / engulfment of target by autophagosome / polyphosphate kinase activity / vacuole fusion, non-autophagic / microautophagy / polyphosphate metabolic process / vacuolar transport / intracellular phosphate ion homeostasis ...vacuolar transporter chaperone complex / ATP-polyphosphate phosphotransferase / polyphosphate biosynthetic process / engulfment of target by autophagosome / polyphosphate kinase activity / vacuole fusion, non-autophagic / microautophagy / polyphosphate metabolic process / vacuolar transport / intracellular phosphate ion homeostasis / fungal-type vacuole membrane / inositol hexakisphosphate binding / vacuolar membrane / autophagosome membrane / cell periphery / cytoplasmic vesicle / cell cortex / nuclear membrane / calmodulin binding / mRNA binding / endoplasmic reticulum membrane / endoplasmic reticulum 類似検索 - 分子機能 | |||||||||||||||||||||||||||||||||
| 生物種 |  | |||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3 Å | |||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Guan, Z.Y. / Chen, J. / Liu, R.W. / Chen, Y.K. / Xing, Q. / Du, Z.M. / Liu, Z. | |||||||||||||||||||||||||||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: The cytoplasmic synthesis and coupled membrane translocation of eukaryotic polyphosphate by signal-activated VTC complex. 著者: Zeyuan Guan / Juan Chen / Ruiwen Liu / Yanke Chen / Qiong Xing / Zhangmeng Du / Meng Cheng / Jianjian Hu / Wenhui Zhang / Wencong Mei / Beijing Wan / Qiang Wang / Jie Zhang / Peng Cheng / ...著者: Zeyuan Guan / Juan Chen / Ruiwen Liu / Yanke Chen / Qiong Xing / Zhangmeng Du / Meng Cheng / Jianjian Hu / Wenhui Zhang / Wencong Mei / Beijing Wan / Qiang Wang / Jie Zhang / Peng Cheng / Huanyu Cai / Jianbo Cao / Delin Zhang / Junjie Yan / Ping Yin / Michael Hothorn / Zhu Liu /   要旨: Inorganic polyphosphate (polyP) is an ancient energy metabolite and phosphate store that occurs ubiquitously in all organisms. The vacuolar transporter chaperone (VTC) complex integrates cytosolic ...Inorganic polyphosphate (polyP) is an ancient energy metabolite and phosphate store that occurs ubiquitously in all organisms. The vacuolar transporter chaperone (VTC) complex integrates cytosolic polyP synthesis from ATP and polyP membrane translocation into the vacuolar lumen. In yeast and in other eukaryotes, polyP synthesis is regulated by inositol pyrophosphate (PP-InsP) nutrient messengers, directly sensed by the VTC complex. Here, we report the cryo-electron microscopy structure of signal-activated VTC complex at 3.0 Å resolution. Baker's yeast VTC subunits Vtc1, Vtc3, and Vtc4 assemble into a 3:1:1 complex. Fifteen trans-membrane helices form a novel membrane channel enabling the transport of newly synthesized polyP into the vacuolar lumen. PP-InsP binding orients the catalytic polymerase domain at the entrance of the trans-membrane channel, both activating the enzyme and coupling polyP synthesis and membrane translocation. Together with biochemical and cellular studies, our work provides mechanistic insights into the biogenesis of an ancient energy metabolite. | |||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7ytj.cif.gz 7ytj.cif.gz | 341 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7ytj.ent.gz pdb7ytj.ent.gz | 269.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7ytj.json.gz 7ytj.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7ytj_validation.pdf.gz 7ytj_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7ytj_full_validation.pdf.gz 7ytj_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  7ytj_validation.xml.gz 7ytj_validation.xml.gz | 55.3 KB | 表示 | |
| CIF形式データ |  7ytj_validation.cif.gz 7ytj_validation.cif.gz | 80.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/yt/7ytj https://data.pdbj.org/pub/pdb/validation_reports/yt/7ytj ftp://data.pdbj.org/pub/pdb/validation_reports/yt/7ytj ftp://data.pdbj.org/pub/pdb/validation_reports/yt/7ytj | HTTPS FTP |
-関連構造データ
| 関連構造データ |  34090MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Vacuolar transporter chaperone ... , 3種, 5分子 DABCE
| #1: タンパク質 | 分子量: 86425.984 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  株: ATCC 204508 / S288c / 遺伝子: VTC4, PHM3, YJL012C, J1345 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P47075 Homo sapiens (ヒト) / 参照: UniProt: P47075 | ||
|---|---|---|---|
| #2: タンパク質 | 分子量: 15943.701 Da / 分子数: 3 / 由来タイプ: 組換発現 由来: (組換発現)  株: ATCC 204508 / S288c / 遺伝子: VTC1, NRF1, PHM4, YER072W / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P40046 Homo sapiens (ヒト) / 参照: UniProt: P40046#3: タンパク質 | | 分子量: 100120.773 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  株: ATCC 204508 / S288c / 遺伝子: VTC3, PHM2, YPL019C / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q02725 Homo sapiens (ヒト) / 参照: UniProt: Q02725 |
-非ポリマー , 3種, 7分子 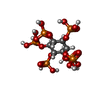
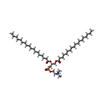



| #4: 化合物 | | #5: 化合物 | #6: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | N |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: VTC complex / タイプ: COMPLEX / Entity ID: #1-#3 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:  |
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) / 細胞: HEK293 Homo sapiens (ヒト) / 細胞: HEK293 |
| 緩衝液 | pH: 8 |
| 試料 | 濃度: 6.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2200 nm / 最小 デフォーカス(公称値): 1200 nm |
| 撮影 | 電子線照射量: 55 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 734934 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj








