+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7yed | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | In situ structure of polymerase complex of mammalian reovirus in the elongation state | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | VIRAL PROTEIN/RNA / mammalian reovirus / cryo-em / RNA dependent RNA polymerase / transcription / VIRAL PROTEIN / VIRAL PROTEIN-RNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報viral inner capsid / host cytoskeleton / viral outer capsid / 7-methylguanosine mRNA capping / viral genome replication / viral capsid / mRNA guanylyltransferase activity / viral nucleocapsid / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / host cell cytoplasm ...viral inner capsid / host cytoskeleton / viral outer capsid / 7-methylguanosine mRNA capping / viral genome replication / viral capsid / mRNA guanylyltransferase activity / viral nucleocapsid / mRNA 5'-cap (guanine-N7-)-methyltransferase activity / host cell cytoplasm / hydrolase activity / RNA helicase activity / RNA-directed RNA polymerase / RNA-directed RNA polymerase activity / GTP binding / structural molecule activity / RNA binding / zinc ion binding / ATP binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Mammalian orthoreovirus 3 (ウイルス) Mammalian orthoreovirus 3 (ウイルス) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3 Å | |||||||||
 データ登録者 データ登録者 | Bao, K.Y. / Zhang, X.L. / Li, D.Y. / Zhu, P. | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: In situ structures of polymerase complex of mammalian reovirus illuminate RdRp activation and transcription regulation. 著者: Keyan Bao / Xueli Zhang / Dongyu Li / Wei Sun / Zhenzhao Sun / Jingfei Wang / Ping Zhu /  要旨: Mammalian reovirus (reovirus) is a multilayered, turreted member of characterized by transcription of dsRNA genome within the innermost capsid shell. Here, we present high-resolution in situ ...Mammalian reovirus (reovirus) is a multilayered, turreted member of characterized by transcription of dsRNA genome within the innermost capsid shell. Here, we present high-resolution in situ structures of reovirus transcriptase complex in an intact double-layered virion, and in the uncoated single-layered core particles in the unloaded, reloaded, pre-elongation, and elongation states, respectively, obtained by cryo-electron microscopy and sub-particle reconstructions. At the template entry of RNA-dependent RNA polymerase (RdRp), the RNA-loading region gets flexible after uncoating resulting in the unloading of terminal genomic RNA and inactivity of transcription. However, upon adding transcriptional substrates, the RNA-loading region is recovered leading the RNAs loaded again. The priming loop in RdRp was found to play a critical role in regulating transcription, which hinders the elongation of transcript in virion and triggers the rearrangement of RdRp C-terminal domain (CTD) during elongation, resulting in splitting of template-transcript hybrid and opening of transcript exit. With the integration of these structures, a transcriptional model of reovirus with five states is proposed. Our structures illuminate the RdRp activation and regulation of the multilayered turreted reovirus. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7yed.cif.gz 7yed.cif.gz | 3.4 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7yed.ent.gz pdb7yed.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  7yed.json.gz 7yed.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7yed_validation.pdf.gz 7yed_validation.pdf.gz | 2.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7yed_full_validation.pdf.gz 7yed_full_validation.pdf.gz | 2.5 MB | 表示 | |
| XML形式データ |  7yed_validation.xml.gz 7yed_validation.xml.gz | 431.5 KB | 表示 | |
| CIF形式データ |  7yed_validation.cif.gz 7yed_validation.cif.gz | 701.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ye/7yed https://data.pdbj.org/pub/pdb/validation_reports/ye/7yed ftp://data.pdbj.org/pub/pdb/validation_reports/ye/7yed ftp://data.pdbj.org/pub/pdb/validation_reports/ye/7yed | HTTPS FTP |
-関連構造データ
| 関連構造データ |  33770MC  7yevC  7yezC  7yf0C  7yfeC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 4種, 22分子 12345ABCDEabcdeHIJKLRU
| #1: タンパク質 | 分子量: 141801.297 Da / 分子数: 15 / 由来タイプ: 天然 / 由来: (天然)  Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E874, RNA helicase Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E874, RNA helicase#2: タンパク質 | 分子量: 143963.438 Da / 分子数: 5 / 由来タイプ: 天然 / 由来: (天然)  Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E871 Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E871#5: タンパク質 | | 分子量: 142472.953 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E870 Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E870#7: タンパク質 | | 分子量: 83434.266 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E872 Mammalian orthoreovirus 3 (ウイルス) / 参照: UniProt: C9E872 |
|---|
-RNA鎖 , 3種, 3分子 MNT
| #3: RNA鎖 | 分子量: 6637.965 Da / 分子数: 1 / 由来タイプ: 合成 / 詳細: Transcript RNA / 由来: (合成)  Mammalian orthoreovirus 3 (ウイルス) Mammalian orthoreovirus 3 (ウイルス) |
|---|---|
| #4: RNA鎖 | 分子量: 11391.729 Da / 分子数: 1 / 由来タイプ: 合成 / 詳細: Encoding RNA / 由来: (合成)  Mammalian orthoreovirus 3 (ウイルス) Mammalian orthoreovirus 3 (ウイルス) |
| #6: RNA鎖 | 分子量: 11391.729 Da / 分子数: 1 / 由来タイプ: 合成 / 詳細: Template RNA / 由来: (合成)  Mammalian orthoreovirus 3 (ウイルス) Mammalian orthoreovirus 3 (ウイルス) |
-非ポリマー , 5種, 26分子 


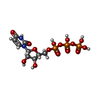





| #8: 化合物 | ChemComp-ZN / #9: 化合物 | ChemComp-SAM / #10: 化合物 | ChemComp-GTP / #11: 化合物 | ChemComp-UTP / | #12: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) | 生物種:  Mammalian orthoreovirus 3 (ウイルス) Mammalian orthoreovirus 3 (ウイルス) | ||||||||||||||||||||||||
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: NO / 単離: STRAIN / タイプ: VIRION | ||||||||||||||||||||||||
| 緩衝液 | pH: 8 | ||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1800 nm / 最小 デフォーカス(公称値): 1500 nm |
| 撮影 | 電子線照射量: 30 e/Å2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: (1.13_2998:phenix.real_space_refine) / 分類: 精密化 |
|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION |
| 3次元再構成 | 解像度: 3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 100968 / 対称性のタイプ: POINT |
| 精密化 | 交差検証法: THROUGHOUT |
| 原子変位パラメータ | Biso max: 316.85 Å2 / Biso mean: 85.9855 Å2 / Biso min: 49.29 Å2 |
 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj






































