+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7ud8 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of carbon monoxy Hemoglobin in complex with 5HMF at 1.8 Angstrom | ||||||||||||
 要素 要素 | (Hemoglobin subunit ...) x 2 | ||||||||||||
 キーワード キーワード | OXYGEN TRANSPORT / hemoglobin / sickle cell disease / antisickling / NO release / oxygen equilibrium | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報nitric oxide transport / hemoglobin alpha binding / cellular oxidant detoxification / hemoglobin binding / haptoglobin-hemoglobin complex / renal absorption / hemoglobin complex / oxygen transport / Scavenging of heme from plasma / endocytic vesicle lumen ...nitric oxide transport / hemoglobin alpha binding / cellular oxidant detoxification / hemoglobin binding / haptoglobin-hemoglobin complex / renal absorption / hemoglobin complex / oxygen transport / Scavenging of heme from plasma / endocytic vesicle lumen / blood vessel diameter maintenance / hydrogen peroxide catabolic process / oxygen carrier activity / carbon dioxide transport / response to hydrogen peroxide / Heme signaling / Erythrocytes take up oxygen and release carbon dioxide / Erythrocytes take up carbon dioxide and release oxygen / Late endosomal microautophagy / Cytoprotection by HMOX1 / oxygen binding / regulation of blood pressure / platelet aggregation / Chaperone Mediated Autophagy / positive regulation of nitric oxide biosynthetic process / tertiary granule lumen / Factors involved in megakaryocyte development and platelet production / blood microparticle / ficolin-1-rich granule lumen / iron ion binding / inflammatory response / heme binding / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / metal ion binding / membrane / cytosol 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å | ||||||||||||
 データ登録者 データ登録者 | Donkor, A.K. / Musayev, F.N. / Safo, M.S. | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Biomolecules / 年: 2022 ジャーナル: Biomolecules / 年: 2022タイトル: Design, Synthesis, and Antisickling Investigation of a Nitric Oxide-Releasing Prodrug of 5HMF for the Treatment of Sickle Cell Disease. 著者: Alhashimi, R.T. / Ghatge, M.S. / Donkor, A.K. / Deshpande, T.M. / Anabaraonye, N. / Alramadhani, D. / Danso-Danquah, R. / Huang, B. / Zhang, Y. / Musayev, F.N. / Abdulmalik, O. / Safo, M.K. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7ud8.cif.gz 7ud8.cif.gz | 141.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7ud8.ent.gz pdb7ud8.ent.gz | 110.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7ud8.json.gz 7ud8.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7ud8_validation.pdf.gz 7ud8_validation.pdf.gz | 3.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7ud8_full_validation.pdf.gz 7ud8_full_validation.pdf.gz | 3.2 MB | 表示 | |
| XML形式データ |  7ud8_validation.xml.gz 7ud8_validation.xml.gz | 31.2 KB | 表示 | |
| CIF形式データ |  7ud8_validation.cif.gz 7ud8_validation.cif.gz | 44.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ud/7ud8 https://data.pdbj.org/pub/pdb/validation_reports/ud/7ud8 ftp://data.pdbj.org/pub/pdb/validation_reports/ud/7ud8 ftp://data.pdbj.org/pub/pdb/validation_reports/ud/7ud8 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7ud7C  3ic0S S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-Hemoglobin subunit ... , 2種, 4分子 ACBD
| #1: タンパク質 | 分子量: 15281.550 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: HBA1, HBA2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: HBA1, HBA2 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P69905 Homo sapiens (ヒト) / 参照: UniProt: P69905#2: タンパク質 | 分子量: 16021.396 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: HBB / 発現宿主: Homo sapiens (ヒト) / 遺伝子: HBB / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P68871 Homo sapiens (ヒト) / 参照: UniProt: P68871 |
|---|
-非ポリマー , 4種, 659分子 

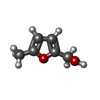




| #3: 化合物 | ChemComp-OXY / #4: 化合物 | ChemComp-HEM / #5: 化合物 |   分子量: 112.127 Da / 分子数: 2 / 由来タイプ: 合成 / 式: C6H8O2 分子量: 112.127 Da / 分子数: 2 / 由来タイプ: 合成 / 式: C6H8O2詳細: The ligand MW0 is an aromatic aldehyde. The aldehyde moiety reacts with the N-terminal amine of Val1 of Hb forming a Schiff-base. That is C1 makes a double bond interaction with the amine ...詳細: The ligand MW0 is an aromatic aldehyde. The aldehyde moiety reacts with the N-terminal amine of Val1 of Hb forming a Schiff-base. That is C1 makes a double bond interaction with the amine nitrogen of hemoglobin. The leaving group is water. タイプ: SUBJECT OF INVESTIGATION #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.7 Å3/Da / 溶媒含有率: 55 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 6.5 詳細: 3.2-3.6M Sulfate/phosphate precipitant, pH 6.5, ferrous citrate |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.5406 Å 回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.5406 Å | ||||||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS EIGER R 4M / 検出器: PIXEL / 日付: 2019年4月15日 / 詳細: VariMax TM-VHF Arc)Sec Confocal Optical System | ||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||
| 放射波長 | 波長: 1.5406 Å / 相対比: 1 | ||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.8→28.39 Å / Num. obs: 66309 / % possible obs: 100 % / 冗長度: 10.8 % / Biso Wilson estimate: 22.64 Å2 / CC1/2: 1 / Rmerge(I) obs: 0.062 / Rpim(I) all: 0.02 / Rrim(I) all: 0.065 / Net I/σ(I): 28.8 / Num. measured all: 716379 / Scaling rejects: 443 | ||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 3IC0 解像度: 1.8→28.386 Å / SU ML: 0.17 / 交差検証法: THROUGHOUT / σ(F): 1.33 / 位相誤差: 22.29 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 77.48 Å2 / Biso mean: 27.2803 Å2 / Biso min: 10.42 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.8→28.386 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj















