[English] 日本語
 Yorodumi
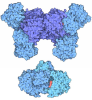
Yorodumi- PDB-7pjn: Crystal Structure of Ivosidenib-resistant IDH1 variant R132C S280... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 7pjn | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of Ivosidenib-resistant IDH1 variant R132C S280F in complex with NADPH and inhibitor DS-1001B | |||||||||
 Components Components | (Isocitrate dehydrogenase [NADP] ...) x 2 | |||||||||
 Keywords Keywords | OXIDOREDUCTASE | |||||||||
| Function / homology |  Function and homology information Function and homology informationAbnormal conversion of 2-oxoglutarate to 2-hydroxyglutarate / NADPH regeneration / regulation of phospholipid catabolic process / regulation of phospholipid biosynthetic process / NFE2L2 regulating TCA cycle genes / isocitrate metabolic process / isocitrate dehydrogenase (NADP+) / isocitrate dehydrogenase (NADP+) activity / NADPH regeneration / NADP+ metabolic process ...Abnormal conversion of 2-oxoglutarate to 2-hydroxyglutarate / NADPH regeneration / regulation of phospholipid catabolic process / regulation of phospholipid biosynthetic process / NFE2L2 regulating TCA cycle genes / isocitrate metabolic process / isocitrate dehydrogenase (NADP+) / isocitrate dehydrogenase (NADP+) activity / NADPH regeneration / NADP+ metabolic process / 2-oxoglutarate metabolic process / glyoxylate cycle / response to steroid hormone / female gonad development / peroxisomal matrix / tricarboxylic acid cycle / glutathione metabolic process / Peroxisomal protein import / NAD binding / tertiary granule lumen / peroxisome / NADP binding / response to oxidative stress / secretory granule lumen / ficolin-1-rich granule lumen / cadherin binding / Neutrophil degranulation / magnesium ion binding / protein homodimerization activity / mitochondrion / extracellular exosome / extracellular region / identical protein binding / cytosol / cytoplasm Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.45 Å MOLECULAR REPLACEMENT / Resolution: 2.45 Å | |||||||||
 Authors Authors | Reinbold, R. / Rabe, P. / Abboud, M.I. / Schofield, C.J. / Clifton, I.J. | |||||||||
| Funding support |  United Kingdom, 2items United Kingdom, 2items
| |||||||||
 Citation Citation |  Journal: Nat Commun / Year: 2022 Journal: Nat Commun / Year: 2022Title: Resistance to the isocitrate dehydrogenase 1 mutant inhibitor ivosidenib can be overcome by alternative dimer-interface binding inhibitors. Authors: Reinbold, R. / Hvinden, I.C. / Rabe, P. / Herold, R.A. / Finch, A. / Wood, J. / Morgan, M. / Staudt, M. / Clifton, I.J. / Armstrong, F.A. / McCullagh, J.S.O. / Redmond, J. / Bardella, C. / ...Authors: Reinbold, R. / Hvinden, I.C. / Rabe, P. / Herold, R.A. / Finch, A. / Wood, J. / Morgan, M. / Staudt, M. / Clifton, I.J. / Armstrong, F.A. / McCullagh, J.S.O. / Redmond, J. / Bardella, C. / Abboud, M.I. / Schofield, C.J. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  7pjn.cif.gz 7pjn.cif.gz | 903.4 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb7pjn.ent.gz pdb7pjn.ent.gz | 770.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  7pjn.json.gz 7pjn.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/pj/7pjn https://data.pdbj.org/pub/pdb/validation_reports/pj/7pjn ftp://data.pdbj.org/pub/pdb/validation_reports/pj/7pjn ftp://data.pdbj.org/pub/pdb/validation_reports/pj/7pjn | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  7pjmC  5tqhS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| Unit cell |
|
- Components
Components
-Isocitrate dehydrogenase [NADP] ... , 2 types, 4 molecules ACDB
| #1: Protein | Mass: 47797.406 Da / Num. of mol.: 3 / Mutation: R132C, S280F Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: IDH1, PICD / Production host: Homo sapiens (human) / Gene: IDH1, PICD / Production host:  References: UniProt: O75874, isocitrate dehydrogenase (NADP+) #2: Protein | | Mass: 47829.406 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: IDH1, PICD / Production host: Homo sapiens (human) / Gene: IDH1, PICD / Production host:  References: UniProt: O75874, isocitrate dehydrogenase (NADP+) |
|---|
-Non-polymers , 5 types, 127 molecules 
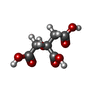

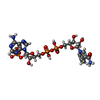





| #3: Chemical | ChemComp-7SU / ( #4: Chemical | ChemComp-CIT / #5: Chemical | ChemComp-GOL / #6: Chemical | ChemComp-NDP / #7: Water | ChemComp-HOH / | |
|---|
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.63 Å3/Da / Density % sol: 53.26 % / Description: rectangle, 100x100 |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, sitting drop / pH: 7 / Details: 2 M Ammonium citrate tribasic, DTT 2 mM |
-Data collection
| Diffraction | Mean temperature: 100 K / Ambient temp details: cryo / Serial crystal experiment: N | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I03 / Wavelength: 0.9999 Å / Beamline: I03 / Wavelength: 0.9999 Å | ||||||||||||||||||||||||||||||
| Detector | Type: DECTRIS EIGER2 XE 16M / Detector: PIXEL / Date: Nov 27, 2020 | ||||||||||||||||||||||||||||||
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.9999 Å / Relative weight: 1 | ||||||||||||||||||||||||||||||
| Reflection | Resolution: 2.45→55.95 Å / Num. obs: 74987 / % possible obs: 100 % / Redundancy: 13.7 % / CC1/2: 1 / Rmerge(I) obs: 0.092 / Rpim(I) all: 0.026 / Rrim(I) all: 0.096 / Net I/σ(I): 18.9 / Num. measured all: 1025494 | ||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1
|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 5TQH Resolution: 2.45→55.36 Å / SU ML: 0.36 / Cross valid method: THROUGHOUT / σ(F): 1.34 / Phase error: 26.39 / Stereochemistry target values: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 182.14 Å2 / Biso mean: 81.1665 Å2 / Biso min: 41.84 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 2.45→55.36 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 26
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller


 PDBj
PDBj