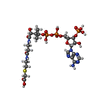+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7mx2 | ||||||
|---|---|---|---|---|---|---|---|
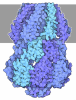
| タイトル | Cryo-EM structure of human ternary NatC complex with a Bisubstrate inhibitor | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE / NatC / NAA30 / NAA35 / NAA38 | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報N-terminal methionine Nalpha-acetyltransferase NatC / NatC complex / smooth muscle cell proliferation / protein N-terminal-methionine acetyltransferase activity / Retrograde transport at the Trans-Golgi-Network / protein-N-terminal amino-acid acetyltransferase activity / protein stabilization / negative regulation of apoptotic process / RNA binding / nucleoplasm ...N-terminal methionine Nalpha-acetyltransferase NatC / NatC complex / smooth muscle cell proliferation / protein N-terminal-methionine acetyltransferase activity / Retrograde transport at the Trans-Golgi-Network / protein-N-terminal amino-acid acetyltransferase activity / protein stabilization / negative regulation of apoptotic process / RNA binding / nucleoplasm / nucleus / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.64 Å | ||||||
 データ登録者 データ登録者 | Deng, S. / Marmorstein, R. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Structure / 年: 2023 ジャーナル: Structure / 年: 2023タイトル: Molecular role of NAA38 in thermostability and catalytic activity of the human NatC N-terminal acetyltransferase. 著者: Sunbin Deng / Sarah M Gardner / Leah Gottlieb / Buyan Pan / E James Petersson / Ronen Marmorstein /  要旨: N-terminal acetylation occurs on over 80% of human proteins and is catalyzed by a family of N-terminal acetyltransferases (NATs). All NATs contain a small catalytic subunit, while some also contain a ...N-terminal acetylation occurs on over 80% of human proteins and is catalyzed by a family of N-terminal acetyltransferases (NATs). All NATs contain a small catalytic subunit, while some also contain a large auxiliary subunit that facilitates catalysis and ribosome targeting for co-translational acetylation. NatC is one of the major NATs containing an NAA30 catalytic subunit, but uniquely contains two auxiliary subunits, large NAA35 and small NAA38. Here, we report the cryo-EM structures of human NatC (hNatC) complexes with and without NAA38, together with biochemical studies, to reveal that NAA38 increases the thermostability and broadens the substrate-specificity profile of NatC by ordering an N-terminal segment of NAA35 and reorienting an NAA30 N-terminal peptide binding loop for optimal catalysis, respectively. We also note important differences in engagement with a stabilizing inositol hexaphosphate molecule between human and yeast NatC. These studies provide new insights for the function and evolution of the NatC complex. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7mx2.cif.gz 7mx2.cif.gz | 162.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7mx2.ent.gz pdb7mx2.ent.gz | 117.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7mx2.json.gz 7mx2.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/mx/7mx2 https://data.pdbj.org/pub/pdb/validation_reports/mx/7mx2 ftp://data.pdbj.org/pub/pdb/validation_reports/mx/7mx2 ftp://data.pdbj.org/pub/pdb/validation_reports/mx/7mx2 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  24070MC  7rb3C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 83754.031 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NAA35, EGAP, MAK10 Homo sapiens (ヒト) / 遺伝子: NAA35, EGAP, MAK10発現宿主:  参照: UniProt: Q5VZE5 |
|---|---|
| #2: タンパク質 | 分子量: 13530.276 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NAA38, LSMD1, MAK31, PFAAP2 Homo sapiens (ヒト) / 遺伝子: NAA38, LSMD1, MAK31, PFAAP2発現宿主:  参照: UniProt: Q9BRA0 |
| #3: タンパク質 | 分子量: 18083.293 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NAA30, C14orf35, MAK3, NAT12 Homo sapiens (ヒト) / 遺伝子: NAA30, C14orf35, MAK3, NAT12発現宿主:  参照: UniProt: Q147X3, N-terminal methionine Nalpha-acetyltransferase NatC |
| #4: タンパク質・ペプチド | 分子量: 416.535 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| #5: 化合物 | ChemComp-CMC / |
| 研究の焦点であるリガンドがあるか | Y |
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.114 MDa / 実験値: NO | ||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  | ||||||||||||||||||||||||
| 緩衝液 | pH: 7 | ||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||
| 試料 | 濃度: 1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK II / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 289 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS | ||||||||||||
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM | ||||||||||||
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1000 nm | ||||||||||||
| 撮影 |
|
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||
| 画像処理 | 詳細: 5372 images | ||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.64 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 172041 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: AB INITIO MODEL / 空間: REAL | ||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj