+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6eqq | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Human butyrylcholinesterase in complex with huprine 19 | |||||||||
 Components Components | Cholinesterase | |||||||||
 Keywords Keywords | HYDROLASE / Complex / Inhibitor / huprine | |||||||||
| Function / homology |  Function and homology information Function and homology informationcholinesterase / : / neuroblast differentiation / response to folic acid / choline binding / Neurotransmitter clearance / response to alkaloid / acetylcholine catabolic process / cholinesterase activity / negative regulation of synaptic transmission ...cholinesterase / : / neuroblast differentiation / response to folic acid / choline binding / Neurotransmitter clearance / response to alkaloid / acetylcholine catabolic process / cholinesterase activity / negative regulation of synaptic transmission / choline metabolic process / peptide hormone processing / hydrolase activity, acting on ester bonds / acetylcholinesterase activity / Aspirin ADME / nuclear envelope lumen / Synthesis of PC / catalytic activity / Synthesis, secretion, and deacylation of Ghrelin / xenobiotic metabolic process / response to glucocorticoid / learning / amyloid-beta binding / blood microparticle / endoplasmic reticulum lumen / negative regulation of cell population proliferation / enzyme binding / extracellular space / extracellular region / identical protein binding / plasma membrane Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.40000447819 Å MOLECULAR REPLACEMENT / Resolution: 2.40000447819 Å | |||||||||
 Authors Authors | Nachon, F. / Brazzolotto, X. / Wandhammer, M. / Trovaslet-Leroy, M. / Rosenberry, T.L. / Macdonald, I.R. / Darvesh, S. | |||||||||
| Funding support |  France, 1items France, 1items
| |||||||||
 Citation Citation |  Journal: Molecules / Year: 2017 Journal: Molecules / Year: 2017Title: Comparison of the Binding of Reversible Inhibitors to Human Butyrylcholinesterase and Acetylcholinesterase: A Crystallographic, Kinetic and Calorimetric Study. Authors: Rosenberry, T.L. / Brazzolotto, X. / Macdonald, I.R. / Wandhammer, M. / Trovaslet-Leroy, M. / Darvesh, S. / Nachon, F. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6eqq.cif.gz 6eqq.cif.gz | 281.4 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6eqq.ent.gz pdb6eqq.ent.gz | 189.3 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6eqq.json.gz 6eqq.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/eq/6eqq https://data.pdbj.org/pub/pdb/validation_reports/eq/6eqq ftp://data.pdbj.org/pub/pdb/validation_reports/eq/6eqq ftp://data.pdbj.org/pub/pdb/validation_reports/eq/6eqq | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  6ep4C  6eqpC  6esjC  6esyC  1p0iS C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||||
| Unit cell |
|
- Components
Components
-Protein , 1 types, 1 molecules A
| #1: Protein | Mass: 59713.512 Da / Num. of mol.: 1 / Mutation: N17Q, N455Q, N481Q, N486Q Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: BCHE, CHE1 / Plasmid: pGS / Cell line (production host): CHO-K1 / Production host: Homo sapiens (human) / Gene: BCHE, CHE1 / Plasmid: pGS / Cell line (production host): CHO-K1 / Production host:  |
|---|
-Sugars , 3 types, 6 molecules 
| #2: Polysaccharide | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-[beta-L-fucopyranose-(1-6)]2-acetamido-2-deoxy-beta- ...2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-[beta-L-fucopyranose-(1-6)]2-acetamido-2-deoxy-beta-D-glucopyranose Source method: isolated from a genetically manipulated source |
|---|---|
| #3: Polysaccharide | beta-L-fucopyranose-(1-6)-2-acetamido-2-deoxy-beta-D-glucopyranose Source method: isolated from a genetically manipulated source |
| #5: Sugar | ChemComp-NAG / |
-Non-polymers , 7 types, 223 molecules 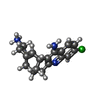










| #4: Chemical | ChemComp-H19 / | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| #6: Chemical | ChemComp-BR / | ||||||||
| #7: Chemical | ChemComp-CL / #8: Chemical | #9: Chemical | ChemComp-GOL / #10: Chemical | ChemComp-UNL / | Mass: 90.121 Da / Num. of mol.: 1 / Source method: obtained synthetically #11: Water | ChemComp-HOH / | |
-Details
| Has protein modification | Y |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 3.36 Å3/Da / Density % sol: 63.42 % |
|---|---|
| Crystal grow | Temperature: 293 K / Method: vapor diffusion, hanging drop / pH: 6.5 / Details: 0.1 M MES buffer, 2.1 M Ammonium sulfate |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  ESRF ESRF  / Beamline: ID29 / Wavelength: 0.979 Å / Beamline: ID29 / Wavelength: 0.979 Å |
| Detector | Type: DECTRIS PILATUS3 6M / Detector: PIXEL / Date: Oct 31, 2014 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.979 Å / Relative weight: 1 |
| Reflection | Resolution: 2.4→57.13 Å / Num. obs: 31862 / % possible obs: 99.91 % / Redundancy: 9.5 % / Biso Wilson estimate: 46.4867618287 Å2 / CC1/2: 0.999 / Rmerge(I) obs: 0.09373 / Rpim(I) all: 0.03181 / Rrim(I) all: 0.0991 / Net I/σ(I): 17.14 |
| Reflection shell | Resolution: 2.4→2.486 Å / Redundancy: 9.1 % / Rmerge(I) obs: 0.922 / Mean I/σ(I) obs: 2.21 / Num. unique obs: 3154 / CC1/2: 0.807 / Rpim(I) all: 0.3206 / Rrim(I) all: 0.9772 / % possible all: 100 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 1P0I Resolution: 2.40000447819→57.1280859052 Å / SU ML: 0.218521836804 / Cross valid method: FREE R-VALUE / σ(F): 1.34365534751 / Phase error: 21.4809239337
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 60.3772836568 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.40000447819→57.1280859052 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller

















 PDBj
PDBj


















