+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5sxf | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal Structure of PI3Kalpha in complex with fragment 9 | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE/TRANSFERASE INHIBITOR / lipid kinase / phosphoinositide / 3-kinase / signaling / TRANSFERASE / TRANSFERASE-TRANSFERASE INHIBITOR complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報perinuclear endoplasmic reticulum membrane / response to muscle inactivity / negative regulation of actin filament depolymerization / regulation of toll-like receptor 4 signaling pathway / response to L-leucine / phosphatidylinositol kinase activity / regulation of actin filament organization / response to butyrate / phosphatidylinositol 3-kinase regulator activity / IRS-mediated signalling ...perinuclear endoplasmic reticulum membrane / response to muscle inactivity / negative regulation of actin filament depolymerization / regulation of toll-like receptor 4 signaling pathway / response to L-leucine / phosphatidylinositol kinase activity / regulation of actin filament organization / response to butyrate / phosphatidylinositol 3-kinase regulator activity / IRS-mediated signalling / cellular response to hydrostatic pressure / autosome genomic imprinting / positive regulation of focal adhesion disassembly / phosphatidylinositol 3-kinase activator activity / interleukin-18-mediated signaling pathway / PI3K events in ERBB4 signaling / myeloid leukocyte migration / 1-phosphatidylinositol-3-kinase regulator activity / phosphatidylinositol 3-kinase regulatory subunit binding / neurotrophin TRKA receptor binding / Activated NTRK2 signals through PI3K / positive regulation of protein localization to membrane / Activated NTRK3 signals through PI3K / cis-Golgi network / ErbB-3 class receptor binding / negative regulation of fibroblast apoptotic process / kinase activator activity / phosphatidylinositol 3-kinase complex, class IB / vasculature development / transmembrane receptor protein tyrosine kinase adaptor activity / RHOF GTPase cycle / RHOD GTPase cycle / Signaling by cytosolic FGFR1 fusion mutants / regulation of cellular respiration / positive regulation of endoplasmic reticulum unfolded protein response / cardiac muscle cell contraction / phosphatidylinositol 3-kinase complex, class IA / enzyme-substrate adaptor activity / anoikis / phosphatidylinositol 3-kinase complex / Nephrin family interactions / Signaling by LTK in cancer / RND1 GTPase cycle / relaxation of cardiac muscle / Costimulation by the CD28 family / Signaling by LTK / positive regulation of leukocyte migration / 1-phosphatidylinositol-4-phosphate 3-kinase activity / 1-phosphatidylinositol-4,5-bisphosphate 3-kinase activity / MET activates PI3K/AKT signaling / RND2 GTPase cycle / PI3K/AKT activation / positive regulation of filopodium assembly / RND3 GTPase cycle / phosphatidylinositol-4,5-bisphosphate 3-kinase / vascular endothelial growth factor signaling pathway / negative regulation of stress fiber assembly / growth hormone receptor signaling pathway / phosphatidylinositol 3-kinase / natural killer cell mediated cytotoxicity / insulin binding / phosphatidylinositol-3-phosphate biosynthetic process / RHOV GTPase cycle / negative regulation of macroautophagy / 1-phosphatidylinositol-3-kinase activity / Signaling by ALK / negative regulation of cell-matrix adhesion / RHOB GTPase cycle / GP1b-IX-V activation signalling / PI-3K cascade:FGFR3 / Erythropoietin activates Phosphoinositide-3-kinase (PI3K) / PI-3K cascade:FGFR2 / protein kinase activator activity / response to dexamethasone / PI-3K cascade:FGFR4 / RHOC GTPase cycle / RHOJ GTPase cycle / PI-3K cascade:FGFR1 / negative regulation of osteoclast differentiation / intracellular glucose homeostasis / CD28 dependent PI3K/Akt signaling / Synthesis of PIPs at the plasma membrane / phosphatidylinositol-mediated signaling / phosphatidylinositol phosphate biosynthetic process / CDC42 GTPase cycle / RHOU GTPase cycle / PI3K events in ERBB2 signaling / negative regulation of anoikis / intercalated disc / RET signaling / T cell differentiation / Interleukin-3, Interleukin-5 and GM-CSF signaling / insulin receptor substrate binding / RHOG GTPase cycle / extrinsic apoptotic signaling pathway via death domain receptors / regulation of multicellular organism growth / PI3K Cascade / RHOA GTPase cycle / endothelial cell migration / positive regulation of TOR signaling 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 3.46 Å フーリエ合成 / 解像度: 3.46 Å | ||||||
 データ登録者 データ登録者 | Gabelli, S.B. / Vogelstein, B. / Miller, M.S. / Amzel, L.M. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Bioorg. Med. Chem. / 年: 2017 ジャーナル: Bioorg. Med. Chem. / 年: 2017タイトル: Identification of allosteric binding sites for PI3K alpha oncogenic mutant specific inhibitor design. 著者: Miller, M.S. / Maheshwari, S. / McRobb, F.M. / Kinzler, K.W. / Amzel, L.M. / Vogelstein, B. / Gabelli, S.B. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5sxf.cif.gz 5sxf.cif.gz | 266.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5sxf.ent.gz pdb5sxf.ent.gz | 207.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5sxf.json.gz 5sxf.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/sx/5sxf https://data.pdbj.org/pub/pdb/validation_reports/sx/5sxf ftp://data.pdbj.org/pub/pdb/validation_reports/sx/5sxf ftp://data.pdbj.org/pub/pdb/validation_reports/sx/5sxf | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  5sw8C  5swgC  5swoC  5swpC  5swrC  5swtC  5sx8C  5sx9C  5sxaC  5sxbC  5sxcC  5sxdC  5sxeC  5sxiC  5sxjC  5sxkC  4ovuS C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 127902.547 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PIK3CA / プラスミド: pFastbac HT-A / 細胞株 (発現宿主): sf9 Homo sapiens (ヒト) / 遺伝子: PIK3CA / プラスミド: pFastbac HT-A / 細胞株 (発現宿主): sf9発現宿主:  参照: UniProt: P42336, phosphatidylinositol-4,5-bisphosphate 3-kinase, non-specific serine/threonine protein kinase |
|---|---|
| #2: タンパク質 | 分子量: 33666.961 Da / 分子数: 1 / Fragment: residues 322-600 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PIK3R1, GRB1 / プラスミド: pFastbac HT-A / 細胞株 (発現宿主): SF9 Homo sapiens (ヒト) / 遺伝子: PIK3R1, GRB1 / プラスミド: pFastbac HT-A / 細胞株 (発現宿主): SF9発現宿主:  参照: UniProt: P27986 |
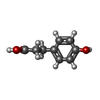
| #3: 化合物 | ChemComp-HPP / |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.97 Å3/Da / 溶媒含有率: 58.55 % / Mosaicity: 0.692 ° / Mosaicity esd: 0.008 ° |
|---|---|
| 結晶化 | 温度: 298 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 7 / 詳細: NaFormate |
-データ収集
| 回折 | 平均測定温度: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ALS ALS  / ビームライン: 5.0.2 / 波長: 1 Å / ビームライン: 5.0.2 / 波長: 1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS PILATUS3 S 6M / 検出器: PIXEL / 日付: 2014年10月17日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 1 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 3.45→91.07 Å / Num. obs: 25565 / % possible obs: 100 % / 冗長度: 7.3 % / Rmerge(I) obs: 0.112 / Net I/av σ(I): 21.1 / Net I/σ(I): 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  フーリエ合成 フーリエ合成開始モデル: 4OVU 解像度: 3.46→91.07 Å / Cor.coef. Fo:Fc: 0.94 / Cor.coef. Fo:Fc free: 0.894 / SU B: 29.325 / SU ML: 0.442 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R Free: 0.605 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : REFINED INDIVIDUALLY
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 308.9 Å2 / Biso mean: 127.991 Å2 / Biso min: 59.85 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 3.46→91.07 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 3.457→3.546 Å / Total num. of bins used: 20
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj