+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5i85 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | aSMase with zinc and phosphocholine | |||||||||
 要素 要素 | Sphingomyelin phosphodiesterase | |||||||||
 キーワード キーワード | HYDROLASE / acid sphingomyelinase / phosphocholine | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報acid sphingomyelin phosphodiesterase activity / sphingomyelin metabolic process / sphingomyelin catabolic process / sphingomyelin phosphodiesterase / lamellar body / sphingomyelin phosphodiesterase activity / phospholipase C / phosphatidylcholine phospholipase C activity / endolysosome / termination of signal transduction ...acid sphingomyelin phosphodiesterase activity / sphingomyelin metabolic process / sphingomyelin catabolic process / sphingomyelin phosphodiesterase / lamellar body / sphingomyelin phosphodiesterase activity / phospholipase C / phosphatidylcholine phospholipase C activity / endolysosome / termination of signal transduction / glycosphingolipid catabolic process / plasma membrane repair / Glycosphingolipid catabolism / ceramide biosynthetic process / hydrolase activity, acting on glycosyl bonds / response to type I interferon / response to ionizing radiation / positive regulation of endocytosis / response to tumor necrosis factor / negative regulation of MAPK cascade / lipid droplet / response to interleukin-1 / cholesterol metabolic process / lysosomal lumen / cellular response to calcium ion / response to cocaine / wound healing / response to virus / cellular response to UV / nervous system development / positive regulation of viral entry into host cell / lysosome / endosome / positive regulation of apoptotic process / symbiont entry into host cell / response to xenobiotic stimulus / signal transduction / extracellular space / extracellular exosome / zinc ion binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.5 Å 分子置換 / 解像度: 2.5 Å | |||||||||
 データ登録者 データ登録者 | Zhou, Y.F. / Wei, R.R. | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2016 ジャーナル: Nat Commun / 年: 2016タイトル: Human acid sphingomyelinase structures provide insight to molecular basis of Niemann-Pick disease. 著者: Zhou, Y.F. / Metcalf, M.C. / Garman, S.C. / Edmunds, T. / Qiu, H. / Wei, R.R. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5i85.cif.gz 5i85.cif.gz | 237.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5i85.ent.gz pdb5i85.ent.gz | 188.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5i85.json.gz 5i85.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5i85_validation.pdf.gz 5i85_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5i85_full_validation.pdf.gz 5i85_full_validation.pdf.gz | 1.4 MB | 表示 | |
| XML形式データ |  5i85_validation.xml.gz 5i85_validation.xml.gz | 24.9 KB | 表示 | |
| CIF形式データ |  5i85_validation.cif.gz 5i85_validation.cif.gz | 35.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/i8/5i85 https://data.pdbj.org/pub/pdb/validation_reports/i8/5i85 ftp://data.pdbj.org/pub/pdb/validation_reports/i8/5i85 ftp://data.pdbj.org/pub/pdb/validation_reports/i8/5i85 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 65114.270 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: SMPD1, ASM / プラスミド: pIRES2 / 細胞株 (発現宿主): HEK293S Gnt1- / 発現宿主: Homo sapiens (ヒト) / 遺伝子: SMPD1, ASM / プラスミド: pIRES2 / 細胞株 (発現宿主): HEK293S Gnt1- / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P17405, sphingomyelin phosphodiesterase Homo sapiens (ヒト) / 参照: UniProt: P17405, sphingomyelin phosphodiesterase |
|---|
-糖 , 4種, 6分子 
| #2: 多糖 | beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta- ...beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
|---|---|
| #3: 多糖 | alpha-D-mannopyranose-(1-3)-alpha-D-mannopyranose-(1-6)-beta-D-mannopyranose-(1-4)-2-acetamido-2- ...alpha-D-mannopyranose-(1-3)-alpha-D-mannopyranose-(1-6)-beta-D-mannopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
| #4: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose |
| #5: 糖 |
-非ポリマー , 4種, 275分子 

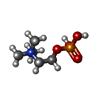




| #6: 化合物 | | #7: 化合物 | ChemComp-SO4 / #8: 化合物 | ChemComp-PC / | #9: 水 | ChemComp-HOH / | |
|---|
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.62 Å3/Da / 溶媒含有率: 66.02 % |
|---|---|
| 結晶化 | 温度: 294 K / 手法: 蒸気拡散法, シッティングドロップ法 詳細: phosphocholine soaked in well solution containing 1.5 M ammonium sulfate, 0.1 M sodium acetate pH 5.0-5.5, 12% glycerol. PH範囲: 5.0-5.5 |
-データ収集
| 回折 | 平均測定温度: 90 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU FR-E+ SUPERBRIGHT / 波長: 1.54 Å 回転陽極 / タイプ: RIGAKU FR-E+ SUPERBRIGHT / 波長: 1.54 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: RIGAKU SATURN 944+ / 検出器: CCD / 日付: 2015年1月8日 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長: 1.54 Å / 相対比: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 2.5→48.7 Å / Num. obs: 34056 / % possible obs: 99.9 % / 冗長度: 17.3 % / Biso Wilson estimate: 30.76 Å2 / Rsym value: 0.2 / Net I/av σ(I): 3.476 / Net I/σ(I): 12.6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
-位相決定
| 位相決定 | 手法:  分子置換 分子置換 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR |
|
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 5I81 解像度: 2.5→31.175 Å / SU ML: 0.26 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 21.73 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.5→31.175 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj




