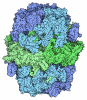
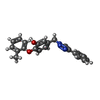
| 登録情報 | データベース: PDB / ID: 5cpf
|
|---|
| タイトル | Compensation of the effect of isoleucine to alanine mutation by designed inhibition in the InhA enzyme |
|---|
 要素 要素 | Enoyl-[acyl-carrier-protein] reductase [NADH] |
|---|
 キーワード キーワード | OXIDOREDUCTASE / Fatty acid biosynthesis inhibition Substrate binding loop conformation Free energy calculation |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
trans-2-enoyl-CoA reductase (NADH) activity / enoyl-[acyl-carrier-protein] reductase (NADH) / enoyl-[acyl-carrier-protein] reductase (NADH) activity / fatty acid biosynthetic process / response to antibiotic類似検索 - 分子機能 : / Enoyl-[acyl-carrier-protein] reductase (NADH) / Enoyl-(Acyl carrier protein) reductase / Short-chain dehydrogenase/reductase SDR / NAD(P)-binding Rossmann-like Domain / NAD(P)-binding domain superfamily / Rossmann fold / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 Chem-53K / NICOTINAMIDE-ADENINE-DINUCLEOTIDE / Enoyl-[acyl-carrier-protein] reductase [NADH]類似検索 - 構成要素 |
|---|
| 生物種 |   Mycobacterium tuberculosis (結核菌) Mycobacterium tuberculosis (結核菌) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 3.409 Å 分子置換 / 解像度: 3.409 Å |
|---|
 データ登録者 データ登録者 | Li, H.-J. / Lai, C.-T. / Pan, P. / Yu, W. / Shah, S. / Bommineni, G.R. / Perrone, V. / Garcia-Diaz, M. / Tonge, P.J. / Simmerling, C. |
|---|
| 資金援助 |  米国, 2件 米国, 2件 | 組織 | 認可番号 | 国 |
|---|
| National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) | GM102864 |  米国 米国 | | National Institutes of Health/National Center for Research Resources (NIH/NCRR) | P41RR012408 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: Biochemistry / 年: 2015 ジャーナル: Biochemistry / 年: 2015
タイトル: Rational Modulation of the Induced-Fit Conformational Change for Slow-Onset Inhibition in Mycobacterium tuberculosis InhA.
著者: Lai, C.T. / Li, H.J. / Yu, W. / Shah, S. / Bommineni, G.R. / Perrone, V. / Garcia-Diaz, M. / Tonge, P.J. / Simmerling, C. |
|---|
| 履歴 | | 登録 | 2015年7月21日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2015年8月12日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2015年8月19日 | Group: Database references |
|---|
| 改定 1.2 | 2017年9月27日 | Group: Author supporting evidence / Database references ...Author supporting evidence / Database references / Derived calculations / Refinement description
カテゴリ: citation / pdbx_audit_support ...citation / pdbx_audit_support / pdbx_struct_oper_list / software
Item: _citation.journal_id_CSD / _pdbx_audit_support.country ..._citation.journal_id_CSD / _pdbx_audit_support.country / _pdbx_audit_support.funding_organization / _pdbx_struct_oper_list.symmetry_operation |
|---|
| 改定 1.3 | 2019年12月4日 | Group: Author supporting evidence / カテゴリ: pdbx_audit_support / Item: _pdbx_audit_support.funding_organization |
|---|
| 改定 1.4 | 2023年9月27日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 3.409 Å
分子置換 / 解像度: 3.409 Å  データ登録者
データ登録者 米国, 2件
米国, 2件  引用
引用 ジャーナル: Biochemistry / 年: 2015
ジャーナル: Biochemistry / 年: 2015 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5cpf.cif.gz
5cpf.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5cpf.ent.gz
pdb5cpf.ent.gz PDB形式
PDB形式 5cpf.json.gz
5cpf.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5cpf_validation.pdf.gz
5cpf_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5cpf_full_validation.pdf.gz
5cpf_full_validation.pdf.gz 5cpf_validation.xml.gz
5cpf_validation.xml.gz 5cpf_validation.cif.gz
5cpf_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/cp/5cpf
https://data.pdbj.org/pub/pdb/validation_reports/cp/5cpf ftp://data.pdbj.org/pub/pdb/validation_reports/cp/5cpf
ftp://data.pdbj.org/pub/pdb/validation_reports/cp/5cpf リンク
リンク 集合体
集合体
 要素
要素 Mycobacterium tuberculosis (strain CDC 1551 / Oshkosh) (結核菌)
Mycobacterium tuberculosis (strain CDC 1551 / Oshkosh) (結核菌)
 X線回折
X線回折 試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  NSLS
NSLS  / ビームライン: X29A / 波長: 1.1 Å
/ ビームライン: X29A / 波長: 1.1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー



























 PDBj
PDBj