| 登録情報 | データベース: PDB / ID: 5bxj
|
|---|
| タイトル | Complex of the Fk1 domain mutant A19T of FKBP51 with 4-Nitrophenol |
|---|
 要素 要素 | Peptidyl-prolyl cis-trans isomerase FKBP5 |
|---|
 キーワード キーワード | ISOMERASE / cochaperone / FK506 / 4-Nitrophenol |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
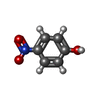
response to alcohol / Modulation of host responses by IFN-stimulated genes / FK506 binding / MECP2 regulates neuronal receptors and channels / : / heat shock protein binding / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / ESR-mediated signaling / peptidyl-prolyl cis-trans isomerase activity / peptidylprolyl isomerase ...response to alcohol / Modulation of host responses by IFN-stimulated genes / FK506 binding / MECP2 regulates neuronal receptors and channels / : / heat shock protein binding / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / ESR-mediated signaling / peptidyl-prolyl cis-trans isomerase activity / peptidylprolyl isomerase / response to cocaine / response to bacterium / protein folding / protein-macromolecule adaptor activity / extracellular exosome / nucleoplasm / membrane / cytosol / cytoplasm類似検索 - 分子機能 : / Chitinase A; domain 3 - #40 / Tetratricopeptide repeat / Chitinase A; domain 3 / Tetratricopeptide repeat / FKBP-type peptidyl-prolyl cis-trans isomerase / FKBP-type peptidyl-prolyl cis-trans isomerase domain / FKBP-type peptidyl-prolyl cis-trans isomerase domain profile. / Peptidyl-prolyl cis-trans isomerase domain superfamily / TPR repeat region circular profile. ...: / Chitinase A; domain 3 - #40 / Tetratricopeptide repeat / Chitinase A; domain 3 / Tetratricopeptide repeat / FKBP-type peptidyl-prolyl cis-trans isomerase / FKBP-type peptidyl-prolyl cis-trans isomerase domain / FKBP-type peptidyl-prolyl cis-trans isomerase domain profile. / Peptidyl-prolyl cis-trans isomerase domain superfamily / TPR repeat region circular profile. / TPR repeat profile. / Tetratricopeptide repeats / Tetratricopeptide repeat / Tetratricopeptide-like helical domain superfamily / Roll / Alpha Beta類似検索 - ドメイン・相同性 P-NITROPHENOL / Peptidyl-prolyl cis-trans isomerase FKBP5類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / 解像度: 1.24 Å シンクロトロン / 解像度: 1.24 Å |
|---|
 データ登録者 データ登録者 | Wu, D. / Tao, X. / Chen, Z. / Han, J. / Jia, W. / Li, X. / Wang, Z. / He, Y.X. |
|---|
| 資金援助 |  中国, 4件 中国, 4件 | 組織 | 認可番号 | 国 |
|---|
| National Natural Science Foundation of China | 31300616 |  中国 中国 | | Fundamental Research Funds of Lanzhou University | lzujbky-2014- 85 |  中国 中国 | | Fundamental Research Funds of Lanzhou University | lzujbky-2013-bt05 |  中国 中国 | | | |
|
|---|
 引用 引用 |  ジャーナル: J. Hazard. Mater. / 年: 2016 ジャーナル: J. Hazard. Mater. / 年: 2016
タイトル: The environmental endocrine disruptor p-nitrophenol interacts with FKBP51, a positive regulator of androgen receptor and inhibits androgen receptor signaling in human cells
著者: Wu, D. / Tao, X. / Chen, Z.P. / Han, J.T. / Jia, W.J. / Zhu, N. / Li, X. / Wang, Z. / He, Y.X. |
|---|
| 履歴 | | 登録 | 2015年6月9日 | 登録サイト: RCSB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2016年5月25日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2024年3月20日 | Group: Data collection / Database references / Derived calculations
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / citation / database_2 / pdbx_struct_oper_list
Item: _citation.country / _database_2.pdbx_DOI ..._citation.country / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_oper_list.symmetry_operation |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン / 解像度: 1.24 Å
シンクロトロン / 解像度: 1.24 Å  データ登録者
データ登録者 中国, 4件
中国, 4件  引用
引用 ジャーナル: J. Hazard. Mater. / 年: 2016
ジャーナル: J. Hazard. Mater. / 年: 2016 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5bxj.cif.gz
5bxj.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5bxj.ent.gz
pdb5bxj.ent.gz PDB形式
PDB形式 5bxj.json.gz
5bxj.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5bxj_validation.pdf.gz
5bxj_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5bxj_full_validation.pdf.gz
5bxj_full_validation.pdf.gz 5bxj_validation.xml.gz
5bxj_validation.xml.gz 5bxj_validation.cif.gz
5bxj_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/bx/5bxj
https://data.pdbj.org/pub/pdb/validation_reports/bx/5bxj ftp://data.pdbj.org/pub/pdb/validation_reports/bx/5bxj
ftp://data.pdbj.org/pub/pdb/validation_reports/bx/5bxj リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: FKBP5, AIG6, FKBP51 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: FKBP5, AIG6, FKBP51 / 発現宿主: 
 X線回折
X線回折 試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRF
SSRF  / ビームライン: BL17U / 波長: 0.9794 Å
/ ビームライン: BL17U / 波長: 0.9794 Å 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj