+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5afi | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 2.9A Structure of E. coli ribosome-EF-TU complex by cs-corrected cryo-EM | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | RIBOSOME / TRANSLATION / PROTEIN SYNTHESIS / DECODING / ELONGATION FACTOR TU / TRNA / RNA MODIFICATION / ANTIBIOTIC | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報guanyl-nucleotide exchange factor complex / protein-synthesizing GTPase / guanosine tetraphosphate binding / negative regulation of cytoplasmic translational initiation / stringent response / ornithine decarboxylase inhibitor activity / transcription antitermination factor activity, RNA binding / misfolded RNA binding / Group I intron splicing / translational elongation ...guanyl-nucleotide exchange factor complex / protein-synthesizing GTPase / guanosine tetraphosphate binding / negative regulation of cytoplasmic translational initiation / stringent response / ornithine decarboxylase inhibitor activity / transcription antitermination factor activity, RNA binding / misfolded RNA binding / Group I intron splicing / translational elongation / RNA folding / transcriptional attenuation / translation elongation factor activity / endoribonuclease inhibitor activity / positive regulation of ribosome biogenesis / RNA-binding transcription regulator activity / translational termination / negative regulation of cytoplasmic translation / four-way junction DNA binding / DnaA-L2 complex / translation repressor activity / negative regulation of translational initiation / regulation of mRNA stability / negative regulation of DNA-templated DNA replication initiation / mRNA regulatory element binding translation repressor activity / assembly of large subunit precursor of preribosome / positive regulation of RNA splicing / ribosome assembly / transcription elongation factor complex / regulation of DNA-templated transcription elongation / cytosolic ribosome assembly / response to reactive oxygen species / DNA endonuclease activity / transcription antitermination / translational initiation / regulation of cell growth / DNA-templated transcription termination / response to radiation / maintenance of translational fidelity / mRNA 5'-UTR binding / ribosome biogenesis / large ribosomal subunit / regulation of translation / transferase activity / ribosome binding / ribosomal small subunit biogenesis / ribosomal small subunit assembly / small ribosomal subunit / 5S rRNA binding / small ribosomal subunit rRNA binding / ribosomal large subunit assembly / cytosolic small ribosomal subunit / large ribosomal subunit rRNA binding / cytosolic large ribosomal subunit / cytoplasmic translation / tRNA binding / negative regulation of translation / rRNA binding / structural constituent of ribosome / ribosome / translation / response to antibiotic / negative regulation of DNA-templated transcription / mRNA binding / GTPase activity / GTP binding / DNA binding / RNA binding / zinc ion binding / membrane / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | ||||||||||||
 データ登録者 データ登録者 | Fischer, N. / Neumann, P. / Konevega, A.L. / Bock, L.V. / Ficner, R. / Rodnina, M.V. / Stark, H. | ||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2015 ジャーナル: Nature / 年: 2015タイトル: Structure of the E. coli ribosome-EF-Tu complex at <3 Å resolution by Cs-corrected cryo-EM. 著者: Niels Fischer / Piotr Neumann / Andrey L Konevega / Lars V Bock / Ralf Ficner / Marina V Rodnina / Holger Stark /  要旨: Single particle electron cryomicroscopy (cryo-EM) has recently made significant progress in high-resolution structure determination of macromolecular complexes due to improvements in electron ...Single particle electron cryomicroscopy (cryo-EM) has recently made significant progress in high-resolution structure determination of macromolecular complexes due to improvements in electron microscopic instrumentation and computational image analysis. However, cryo-EM structures can be highly non-uniform in local resolution and all structures available to date have been limited to resolutions above 3 Å. Here we present the cryo-EM structure of the 70S ribosome from Escherichia coli in complex with elongation factor Tu, aminoacyl-tRNA and the antibiotic kirromycin at 2.65-2.9 Å resolution using spherical aberration (Cs)-corrected cryo-EM. Overall, the cryo-EM reconstruction at 2.9 Å resolution is comparable to the best-resolved X-ray structure of the E. coli 70S ribosome (2.8 Å), but provides more detailed information (2.65 Å) at the functionally important ribosomal core. The cryo-EM map elucidates for the first time the structure of all 35 rRNA modifications in the bacterial ribosome, explaining their roles in fine-tuning ribosome structure and function and modulating the action of antibiotics. We also obtained atomic models for flexible parts of the ribosome such as ribosomal proteins L9 and L31. The refined cryo-EM-based model presents the currently most complete high-resolution structure of the E. coli ribosome, which demonstrates the power of cryo-EM in structure determination of large and dynamic macromolecular complexes. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5afi.cif.gz 5afi.cif.gz | 6.1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5afi.ent.gz pdb5afi.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  5afi.json.gz 5afi.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5afi_validation.pdf.gz 5afi_validation.pdf.gz | 897 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5afi_full_validation.pdf.gz 5afi_full_validation.pdf.gz | 1020.9 KB | 表示 | |
| XML形式データ |  5afi_validation.xml.gz 5afi_validation.xml.gz | 167.6 KB | 表示 | |
| CIF形式データ |  5afi_validation.cif.gz 5afi_validation.cif.gz | 288.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/af/5afi https://data.pdbj.org/pub/pdb/validation_reports/af/5afi ftp://data.pdbj.org/pub/pdb/validation_reports/af/5afi ftp://data.pdbj.org/pub/pdb/validation_reports/af/5afi | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-RNA鎖 , 6種, 7分子 avwxyAB
| #1: RNA鎖 | 分子量: 498909.844 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| #22: RNA鎖 | 分子量: 24818.893 Da / 分子数: 2 / Fragment: Residues 49-125 / 由来タイプ: 天然 / 由来: (天然)  #23: RNA鎖 | | 分子量: 3492.122 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  #24: RNA鎖 | | 分子量: 24797.088 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  #26: RNA鎖 | | 分子量: 941521.375 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  #27: RNA鎖 | | 分子量: 38813.133 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-30S ribosomal protein ... , 20種, 20分子 bcdefghijklmnopqrstu
| #2: タンパク質 | 分子量: 26652.557 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #3: タンパク質 | 分子量: 26031.316 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #4: タンパク質 | 分子量: 23514.199 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #5: タンパク質 | 分子量: 17629.398 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #6: タンパク質 | 分子量: 15727.512 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #7: タンパク質 | 分子量: 20055.156 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #8: タンパク質 | 分子量: 14146.557 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #9: タンパク質 | 分子量: 14886.270 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #10: タンパク質 | 分子量: 11755.597 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #11: タンパク質 | 分子量: 13870.975 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #12: タンパク質 | 分子量: 13768.157 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #13: タンパク質 | 分子量: 13128.467 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #14: タンパク質 | 分子量: 11677.637 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #15: タンパク質 | 分子量: 10290.816 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #16: タンパク質 | 分子量: 9207.572 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #17: タンパク質 | 分子量: 9724.491 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #18: タンパク質 | 分子量: 9005.472 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #19: タンパク質 | 分子量: 10455.355 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #20: タンパク質 | 分子量: 9708.464 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #21: タンパク質 | 分子量: 8524.039 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-タンパク質 , 1種, 1分子 z
| #25: タンパク質 | 分子量: 43239.297 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|
+50S ribosomal protein ... , 31種, 31分子 CDEFGHIJKLMNOPQRSTUVWXYZ0123456
-非ポリマー , 8種, 363分子 

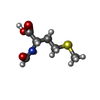
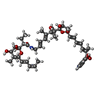











| #59: 化合物 | ChemComp-MG / #60: 化合物 | #61: 化合物 | ChemComp-FME / | #62: 化合物 | ChemComp-KIR / | #63: 化合物 | ChemComp-GDP / | #64: 化合物 | #65: 化合物 | #66: 水 | ChemComp-HOH / | |
|---|
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: E. COLI 70S-EF-TU-GDP- KIRROMYCIN-PHE-TRNAPHE- FMET-TRNAFMET-TRNAFMET COMPLEX タイプ: RIBOSOME |
|---|---|
| 緩衝液 | 名称: 50MM HEPES-KOH, 70MMNH4CL, 30MM KCL, 20MM MGCL2, 1MM DTT, 0.6MM SPERMINE, 0.4MM SPERMIDINE, 0.15MM KIRROMYCIN pH: 7.5 詳細: 50MM HEPES-KOH, 70MMNH4CL, 30MM KCL, 20MM MGCL2, 1MM DTT, 0.6MM SPERMINE, 0.4MM SPERMIDINE, 0.15MM KIRROMYCIN |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | 詳細: CARBON |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 詳細: LIQUIDE ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS / 日付: 2011年12月20日 |
| 電子銃 | 電子線源: OTHER / 加速電圧: 300 kV / 照射モード: SPOT SCAN |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 192000 X / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 700 nm / Cs: 0.01 mm |
| 撮影 | 電子線照射量: 40 e/Å2 フィルム・検出器のモデル: FEI FALCON I (4k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | 詳細: LOCAL CTF CORRECTION | ||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||
| 3次元再構成 | 解像度: 2.9 Å / 粒子像の数: 417201 / ピクセルサイズ(実測値): 0.75525 Å 倍率補正: CROSS- -CORRELATION WITH PUBLISHED ATOMIC COORDINATES 対称性のタイプ: POINT | ||||||||||||||||
| 原子モデル構築 | 空間: REAL | ||||||||||||||||
| 精密化 | 最高解像度: 2.9 Å |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera




















 PDBj
PDBj




































