| 登録情報 | データベース: PDB / ID: 4qrf
|
|---|
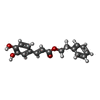
| タイトル | Crystal structure of V30M mutant human transthyretin complexed with caffeic acid phenethyl ester |
|---|
 要素 要素 | Transthyretin |
|---|
 キーワード キーワード | TRANSPORT PROTEIN / transporter / thyroxine binding |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
Defective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / hormone binding / purine nucleobase metabolic process / molecular sequestering activity / Non-integrin membrane-ECM interactions / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport ...Defective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / hormone binding / purine nucleobase metabolic process / molecular sequestering activity / Non-integrin membrane-ECM interactions / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / protein-containing complex binding / protein-containing complex / extracellular space / extracellular exosome / extracellular region / identical protein binding類似検索 - 分子機能 Transthyretin/hydroxyisourate hydrolase domain / Transthyretin, conserved site / Transthyretin signature 2. / Transthyretin, thyroxine binding site / Transthyretin signature 1. / Transthyretin / Transthyretin/hydroxyisourate hydrolase / Transthyretin/hydroxyisourate hydrolase domain / Transthyretin/hydroxyisourate hydrolase domain superfamily / HIUase/Transthyretin family ...Transthyretin/hydroxyisourate hydrolase domain / Transthyretin, conserved site / Transthyretin signature 2. / Transthyretin, thyroxine binding site / Transthyretin signature 1. / Transthyretin / Transthyretin/hydroxyisourate hydrolase / Transthyretin/hydroxyisourate hydrolase domain / Transthyretin/hydroxyisourate hydrolase domain superfamily / HIUase/Transthyretin family / Immunoglobulin-like / Sandwich / Mainly Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å |
|---|
 データ登録者 データ登録者 | Yokoyama, T. / Kosaka, Y. / Mizuguchi, M. |
|---|
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2014 ジャーナル: J.Med.Chem. / 年: 2014
タイトル: Inhibitory Activities of Propolis and Its Promising Component, Caffeic Acid Phenethyl Ester, against Amyloidogenesis of Human Transthyretin
著者: Yokoyama, T. / Kosaka, Y. / Mizuguchi, M. |
|---|
| 履歴 | | 登録 | 2014年6月30日 | 登録サイト: RCSB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2014年11月26日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2023年11月8日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / pdbx_struct_special_symmetry / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.8 Å
分子置換 / 解像度: 1.8 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Med.Chem. / 年: 2014
ジャーナル: J.Med.Chem. / 年: 2014 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4qrf.cif.gz
4qrf.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4qrf.ent.gz
pdb4qrf.ent.gz PDB形式
PDB形式 4qrf.json.gz
4qrf.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 4qrf_validation.pdf.gz
4qrf_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 4qrf_full_validation.pdf.gz
4qrf_full_validation.pdf.gz 4qrf_validation.xml.gz
4qrf_validation.xml.gz 4qrf_validation.cif.gz
4qrf_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/qr/4qrf
https://data.pdbj.org/pub/pdb/validation_reports/qr/4qrf ftp://data.pdbj.org/pub/pdb/validation_reports/qr/4qrf
ftp://data.pdbj.org/pub/pdb/validation_reports/qr/4qrf リンク
リンク 集合体
集合体

 要素
要素 Homo sapiens (ヒト) / 遺伝子: TTR, PALB / プラスミド: pQE-30 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: TTR, PALB / プラスミド: pQE-30 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Photon Factory
Photon Factory  / ビームライン: AR-NW12A / 波長: 1 Å
/ ビームライン: AR-NW12A / 波長: 1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー




















 PDBj
PDBj