| 登録情報 | データベース: PDB / ID: 4n7h
|
|---|
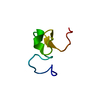
| タイトル | Crystal Structure of the Complex of 3rd WW domain of Human Nedd4 and 1st PPXY Motif of ARRDC3 |
|---|
 要素 要素 | - Arrestin domain-containing protein 3
- E3 ubiquitin-protein ligase NEDD4
|
|---|
 キーワード キーワード | PROTEIN BINDING / ww domain / Beta sheet / PPXY motif |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of heat generation / beta-3 adrenergic receptor binding / formation of structure involved in a symbiotic process / positive regulation of nucleocytoplasmic transport / negative regulation of locomotion involved in locomotory behavior / negative regulation of sodium ion transport / regulation of potassium ion transmembrane transporter activity / viral budding / nuclear receptor-mediated glucocorticoid signaling pathway / negative regulation of adenylate cyclase-activating adrenergic receptor signaling pathway ...negative regulation of heat generation / beta-3 adrenergic receptor binding / formation of structure involved in a symbiotic process / positive regulation of nucleocytoplasmic transport / negative regulation of locomotion involved in locomotory behavior / negative regulation of sodium ion transport / regulation of potassium ion transmembrane transporter activity / viral budding / nuclear receptor-mediated glucocorticoid signaling pathway / negative regulation of adenylate cyclase-activating adrenergic receptor signaling pathway / positive regulation of hippo signaling / : / phosphothreonine residue binding / receptor catabolic process / apicolateral plasma membrane / protein targeting to lysosome / ubiquitin-dependent protein catabolic process via the multivesicular body sorting pathway / regulation of monoatomic ion transmembrane transport / HECT-type E3 ubiquitin transferase / proline-rich region binding / sodium channel inhibitor activity / RNA polymerase binding / heat generation / beta-2 adrenergic receptor binding / negative regulation of cold-induced thermogenesis / positive regulation of ubiquitin-protein transferase activity / lysosomal transport / fat pad development / regulation of dendrite morphogenesis / negative regulation of vascular endothelial growth factor receptor signaling pathway / skin development / neuromuscular junction development / regulation of synapse organization / phosphoserine residue binding / protein K63-linked ubiquitination / ubiquitin ligase complex / regulation of macroautophagy / progesterone receptor signaling pathway / Downregulation of ERBB4 signaling / Regulation of PTEN localization / ubiquitin binding / regulation of membrane potential / receptor internalization / ISG15 antiviral mechanism / Regulation of PTEN stability and activity / response to calcium ion / positive regulation of protein catabolic process / neuron projection development / ubiquitin-protein transferase activity / cellular response to UV / ubiquitin protein ligase activity / Antigen processing: Ubiquitination & Proteasome degradation / protein transport / cell cortex / ubiquitin-dependent protein catabolic process / early endosome / lysosome / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / endosome / protein ubiquitination / protein domain specific binding / innate immune response / DNA damage response / chromatin / perinuclear region of cytoplasm / enzyme binding / negative regulation of transcription by RNA polymerase II / Golgi apparatus / protein-containing complex / extracellular exosome / nucleoplasm / nucleus / plasma membrane / cytosol / cytoplasm類似検索 - 分子機能 : / Arrestin-like, N-terminal / Arrestin C-terminal-like domain / Arrestin (or S-antigen), N-terminal domain / Arrestin (or S-antigen), C-terminal domain / Arrestin (or S-antigen), C-terminal domain / : / Arrestin-like, C-terminal / HECT domain / HECT, E3 ligase catalytic domain ...: / Arrestin-like, N-terminal / Arrestin C-terminal-like domain / Arrestin (or S-antigen), N-terminal domain / Arrestin (or S-antigen), C-terminal domain / Arrestin (or S-antigen), C-terminal domain / : / Arrestin-like, C-terminal / HECT domain / HECT, E3 ligase catalytic domain / HECT-domain (ubiquitin-transferase) / HECT domain profile. / Domain Homologous to E6-AP Carboxyl Terminus with / WW domain / WW/rsp5/WWP domain signature. / WW domain superfamily / WW/rsp5/WWP domain profile. / Domain with 2 conserved Trp (W) residues / WW domain / C2 domain superfamily / Immunoglobulin E-set類似検索 - ドメイン・相同性 GUANIDINE / E3 ubiquitin-protein ligase NEDD4 / Arrestin domain-containing protein 3類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / 解像度: 1.698 Å シンクロトロン / 解像度: 1.698 Å |
|---|
 データ登録者 データ登録者 | Qi, S. / O'Hayre, M. / Gutkind, J.S. / Hurley, J. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2014 ジャーナル: J.Biol.Chem. / 年: 2014
タイトル: Structural and biochemical basis for ubiquitin ligase recruitment by arrestin-related domain-containing protein-3 (ARRDC3).
著者: Qi, S. / O'Hayre, M. / Gutkind, J.S. / Hurley, J.H. |
|---|
| 履歴 | | 登録 | 2013年10月15日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2014年1月8日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2014年2月5日 | Group: Database references |
|---|
| 改定 1.2 | 2014年10月8日 | Group: Database references |
|---|
| 改定 1.3 | 2024年2月28日 | Group: Data collection / Database references / Derived calculations
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン / 解像度: 1.698 Å
シンクロトロン / 解像度: 1.698 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2014
ジャーナル: J.Biol.Chem. / 年: 2014 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 4n7h.cif.gz
4n7h.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb4n7h.ent.gz
pdb4n7h.ent.gz PDB形式
PDB形式 4n7h.json.gz
4n7h.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/n7/4n7h
https://data.pdbj.org/pub/pdb/validation_reports/n7/4n7h ftp://data.pdbj.org/pub/pdb/validation_reports/n7/4n7h
ftp://data.pdbj.org/pub/pdb/validation_reports/n7/4n7h リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: KIAA0093, NEDD4, NEDD4-1, PIG53 / プラスミド: pGST-parallel2 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: KIAA0093, NEDD4, NEDD4-1, PIG53 / プラスミド: pGST-parallel2 / 発現宿主: 
 Homo sapiens (ヒト) / 参照: UniProt: Q96B67
Homo sapiens (ヒト) / 参照: UniProt: Q96B67 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-ID / 波長: 1 Å
/ ビームライン: 22-ID / 波長: 1 Å 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj