[English] 日本語
 Yorodumi
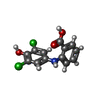
Yorodumi- PDB-3m1o: Human Transthyretin (TTR) complexed with 2-((3,5-dichloro-4-hydro... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 3m1o | ||||||
|---|---|---|---|---|---|---|---|
| Title | Human Transthyretin (TTR) complexed with 2-((3,5-dichloro-4-hydroxyphenyl)amino)benzoic acid | ||||||
 Components Components | Transthyretin | ||||||
 Keywords Keywords | HORMONE / AMYLOID / INHIBITOR / AMYLOIDOSIS / DISEASE MUTATION / GAMMA-CARBOXYGLUTAMIC ACID / GLYCOPROTEIN / NEUROPATHY / SECRETED / THYROID HORMONE / TRANSPORT | ||||||
| Function / homology |  Function and homology information Function and homology informationDefective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / hormone binding / Non-integrin membrane-ECM interactions / molecular sequestering activity / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport ...Defective visual phototransduction due to STRA6 loss of function / negative regulation of glomerular filtration / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / hormone binding / Non-integrin membrane-ECM interactions / molecular sequestering activity / phototransduction, visible light / retinoid metabolic process / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / protein-containing complex binding / protein-containing complex / extracellular space / extracellular exosome / extracellular region / identical protein binding Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.2 Å MOLECULAR REPLACEMENT / Resolution: 1.2 Å | ||||||
 Authors Authors | Kolstoe, S.E. / Wood, S.P. | ||||||
 Citation Citation |  Journal: Proc.Natl.Acad.Sci.USA / Year: 2010 Journal: Proc.Natl.Acad.Sci.USA / Year: 2010Title: Trapping of palindromic ligands within native transthyretin prevents amyloid formation. Authors: Kolstoe, S.E. / Mangione, P.P. / Bellotti, V. / Taylor, G.W. / Tennent, G.A. / Deroo, S. / Morrison, A.J. / Cobb, A.J. / Coyne, A. / McCammon, M.G. / Warner, T.D. / Mitchell, J. / Gill, R. / ...Authors: Kolstoe, S.E. / Mangione, P.P. / Bellotti, V. / Taylor, G.W. / Tennent, G.A. / Deroo, S. / Morrison, A.J. / Cobb, A.J. / Coyne, A. / McCammon, M.G. / Warner, T.D. / Mitchell, J. / Gill, R. / Smith, M.D. / Ley, S.V. / Robinson, C.V. / Wood, S.P. / Pepys, M.B. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  3m1o.cif.gz 3m1o.cif.gz | 119.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb3m1o.ent.gz pdb3m1o.ent.gz | 93.4 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  3m1o.json.gz 3m1o.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/m1/3m1o https://data.pdbj.org/pub/pdb/validation_reports/m1/3m1o ftp://data.pdbj.org/pub/pdb/validation_reports/m1/3m1o ftp://data.pdbj.org/pub/pdb/validation_reports/m1/3m1o | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  3ipbC  3ipeC  2roxS  3ipg C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| |||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| |||||||||||||||||||||||||||||||||||||||
| Unit cell |
| |||||||||||||||||||||||||||||||||||||||
| Components on special symmetry positions |
|
- Components
Components
| #1: Protein | Mass: 13777.360 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: TTR, PALB / Production host: Homo sapiens (human) / Gene: TTR, PALB / Production host:  #2: Chemical | #3: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.1 Å3/Da / Density % sol: 41.32 % |
|---|---|
| Crystal grow | Temperature: 298 K / Method: vapor diffusion, hanging drop Details: 25- 32% V/V PEG550-MONOMETHYL ETHER, 70 MM NAAC BUFFER PH 4-5 AND 100 MM NACL, VAPOR DIFFUSION, HANGING DROP, temperature 298K PH range: 4-5 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I04 / Wavelength: 0.98 Å / Beamline: I04 / Wavelength: 0.98 Å |
| Detector | Type: ADSC QUANTUM 315 / Detector: CCD / Date: Dec 13, 2008 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.98 Å / Relative weight: 1 |
| Reflection | Resolution: 1.2→38.07 Å / Num. all: 73223 / Num. obs: 73223 / % possible obs: 100 % / Redundancy: 9.8 % / Biso Wilson estimate: 9.9 Å2 / Rmerge(I) obs: 0.081 / Net I/σ(I): 14.2 |
| Reflection shell | Resolution: 1.2→1.26 Å / Redundancy: 6.4 % / Rmerge(I) obs: 0.468 / Mean I/σ(I) obs: 3.4 / Num. unique all: 10525 / % possible all: 100 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 2ROX Resolution: 1.2→35.453 Å / Isotropic thermal model: anisotropic / Cross valid method: THROUGHOUT / Stereochemistry target values: Engh & Huber
| |||||||||||||||||||||||||
| Displacement parameters | Biso mean: 12.09 Å2
| |||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.2→35.453 Å
| |||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.2→1.2158 Å
|
 Movie
Movie Controller
Controller











 PDBj
PDBj