| 登録情報 | データベース: PDB / ID: 3ln2
|
|---|
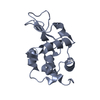
| タイトル | Crystal Structure of a Charge Engineered Human Lysozyme Variant |
|---|
 要素 要素 | Lysozyme C |
|---|
 キーワード キーワード | HYDROLASE / Human Lysozyme / Charge Engineered human lysozyme / Protein engineering / Antimicrobial / Bacteriolytic / Surface Mutation / Amyloid / Amyloidosis / Bacteriolytic enzyme / Disease mutation / Disulfide bond / Glycosidase |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
antimicrobial humoral response / Antimicrobial peptides / specific granule lumen / azurophil granule lumen / lysozyme / lysozyme activity / tertiary granule lumen / defense response to Gram-negative bacterium / killing of cells of another organism / defense response to Gram-positive bacterium ...antimicrobial humoral response / Antimicrobial peptides / specific granule lumen / azurophil granule lumen / lysozyme / lysozyme activity / tertiary granule lumen / defense response to Gram-negative bacterium / killing of cells of another organism / defense response to Gram-positive bacterium / defense response to bacterium / inflammatory response / Amyloid fiber formation / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / identical protein binding類似検索 - 分子機能 Lysozyme - #10 / Glycoside hydrolase, family 22, lysozyme / Glycoside hydrolase family 22 domain / Glycosyl hydrolases family 22 (GH22) domain signature. / Glycoside hydrolase, family 22 / C-type lysozyme/alpha-lactalbumin family / Glycosyl hydrolases family 22 (GH22) domain profile. / Alpha-lactalbumin / lysozyme C / Lysozyme / Lysozyme-like domain superfamily ...Lysozyme - #10 / Glycoside hydrolase, family 22, lysozyme / Glycoside hydrolase family 22 domain / Glycosyl hydrolases family 22 (GH22) domain signature. / Glycoside hydrolase, family 22 / C-type lysozyme/alpha-lactalbumin family / Glycosyl hydrolases family 22 (GH22) domain profile. / Alpha-lactalbumin / lysozyme C / Lysozyme / Lysozyme-like domain superfamily / Orthogonal Bundle / Mainly Alpha類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.037 Å 分子置換 / 解像度: 2.037 Å |
|---|
 データ登録者 データ登録者 | Gill, A. / Scanlon, T.C. / Griswold, K.E. |
|---|
 引用 引用 |  ジャーナル: Plos One / 年: 2011 ジャーナル: Plos One / 年: 2011
タイトル: Crystal structure of a charge engineered human lysozyme having enhanced bactericidal activity.
著者: Gill, A. / Scanlon, T.C. / Osipovitch, D.C. / Madden, D.R. / Griswold, K.E. |
|---|
| 履歴 | | 登録 | 2010年2月1日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2011年2月16日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2021年10月13日 | Group: Database references / カテゴリ: database_2 / struct_ref_seq_dif
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details |
|---|
| 改定 1.3 | 2023年9月6日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
| 改定 1.4 | 2024年10月16日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  分子置換 / 解像度: 2.037 Å
分子置換 / 解像度: 2.037 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Plos One / 年: 2011
ジャーナル: Plos One / 年: 2011 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3ln2.cif.gz
3ln2.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3ln2.ent.gz
pdb3ln2.ent.gz PDB形式
PDB形式 3ln2.json.gz
3ln2.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/ln/3ln2
https://data.pdbj.org/pub/pdb/validation_reports/ln/3ln2 ftp://data.pdbj.org/pub/pdb/validation_reports/ln/3ln2
ftp://data.pdbj.org/pub/pdb/validation_reports/ln/3ln2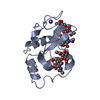
 リンク
リンク 集合体
集合体

 要素
要素 Homo sapiens (ヒト) / 遺伝子: LYZ, LZM / プラスミド: pRS416-GAL1 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: LYZ, LZM / プラスミド: pRS416-GAL1 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU RUH3R / 波長: 1.54 Å
回転陽極 / タイプ: RIGAKU RUH3R / 波長: 1.54 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj



