| 登録情報 | データベース: PDB / ID: 3l0v
|
|---|
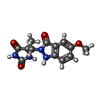
| タイトル | Crystal structure of catalytic domain of TACE with the first hydantoin inhibitor occupying the S1' pocket |
|---|
 要素 要素 | Disintegrin and metalloproteinase domain-containing protein 17 |
|---|
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / Metal-binding / Metalloprotease / Notch signaling pathway / Protease / HYDROLASE-HYDROLASE INHIBITOR complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
ADAM 17 endopeptidase / regulation of mast cell apoptotic process / metalloendopeptidase activity involved in amyloid precursor protein catabolic process / cellular response to high density lipoprotein particle stimulus / positive regulation of epidermal growth factor-activated receptor activity / Constitutive Signaling by NOTCH1 t(7;9)(NOTCH1:M1580_K2555) Translocation Mutant / Notch receptor processing / interleukin-6 receptor binding / tumor necrosis factor binding / positive regulation of T cell chemotaxis ...ADAM 17 endopeptidase / regulation of mast cell apoptotic process / metalloendopeptidase activity involved in amyloid precursor protein catabolic process / cellular response to high density lipoprotein particle stimulus / positive regulation of epidermal growth factor-activated receptor activity / Constitutive Signaling by NOTCH1 t(7;9)(NOTCH1:M1580_K2555) Translocation Mutant / Notch receptor processing / interleukin-6 receptor binding / tumor necrosis factor binding / positive regulation of T cell chemotaxis / TNF signaling / germinal center formation / Regulated proteolysis of p75NTR / Release of Hh-Np from the secreting cell / commissural neuron axon guidance / positive regulation of tumor necrosis factor-mediated signaling pathway / neutrophil mediated immunity / wound healing, spreading of epidermal cells / Notch binding / negative regulation of cold-induced thermogenesis / positive regulation of leukocyte chemotaxis / CD163 mediating an anti-inflammatory response / positive regulation of vascular endothelial cell proliferation / positive regulation of epidermal growth factor receptor signaling pathway / cell adhesion mediated by integrin / Signaling by EGFR / amyloid precursor protein catabolic process / membrane protein ectodomain proteolysis / Collagen degradation / positive regulation of cyclin-dependent protein serine/threonine kinase activity / positive regulation of blood vessel endothelial cell migration / positive regulation of G1/S transition of mitotic cell cycle / Growth hormone receptor signaling / positive regulation of chemokine production / Nuclear signaling by ERBB4 / Notch signaling pathway / spleen development / Constitutive Signaling by NOTCH1 HD Domain Mutants / Activated NOTCH1 Transmits Signal to the Nucleus / B cell differentiation / PDZ domain binding / cell motility / negative regulation of transforming growth factor beta receptor signaling pathway / protein processing / metalloendopeptidase activity / Constitutive Signaling by NOTCH1 PEST Domain Mutants / Constitutive Signaling by NOTCH1 HD+PEST Domain Mutants / SH3 domain binding / metallopeptidase activity / actin cytoskeleton / integrin binding / peptidase activity / T cell differentiation in thymus / positive regulation of cell growth / endopeptidase activity / response to lipopolysaccharide / cell adhesion / response to hypoxia / defense response to Gram-positive bacterium / positive regulation of cell migration / response to xenobiotic stimulus / membrane raft / apical plasma membrane / endoplasmic reticulum lumen / Golgi membrane / positive regulation of cell population proliferation / cell surface / proteolysis / membrane / metal ion binding / plasma membrane / cytoplasm / cytosol類似検索 - 分子機能 Metallo-peptidase family M12 / ADAM17, membrane-proximal domain / Membrane-proximal domain, switch, for ADAM17 / ADAM10/ADAM17 catalytic domain / Metallo-peptidase family M12B Reprolysin-like / Disintegrin / Disintegrin domain profile. / Homologues of snake disintegrins / Disintegrin domain / Disintegrin domain superfamily ...Metallo-peptidase family M12 / ADAM17, membrane-proximal domain / Membrane-proximal domain, switch, for ADAM17 / ADAM10/ADAM17 catalytic domain / Metallo-peptidase family M12B Reprolysin-like / Disintegrin / Disintegrin domain profile. / Homologues of snake disintegrins / Disintegrin domain / Disintegrin domain superfamily / Peptidase M12B, ADAM/reprolysin / ADAM type metalloprotease domain profile. / Collagenase (Catalytic Domain) / Collagenase (Catalytic Domain) / Metallopeptidase, catalytic domain superfamily / Neutral zinc metallopeptidases, zinc-binding region signature. / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 Chem-724 / Disintegrin and metalloproteinase domain-containing protein 17類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.75 Å 分子置換 / 解像度: 1.75 Å |
|---|
 データ登録者 データ登録者 | Orth, P. |
|---|
 引用 引用 |  ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2010 ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2010
タイトル: Discovery and SAR of hydantoin TACE inhibitors.
著者: Yu, W. / Guo, Z. / Orth, P. / Madison, V. / Chen, L. / Dai, C. / Feltz, R.J. / Girijavallabhan, V.M. / Kim, S.H. / Kozlowski, J.A. / Lavey, B.J. / Li, D. / Lundell, D. / Niu, X. / Piwinski, J. ...著者: Yu, W. / Guo, Z. / Orth, P. / Madison, V. / Chen, L. / Dai, C. / Feltz, R.J. / Girijavallabhan, V.M. / Kim, S.H. / Kozlowski, J.A. / Lavey, B.J. / Li, D. / Lundell, D. / Niu, X. / Piwinski, J.J. / Popovici-Muller, J. / Rizvi, R. / Rosner, K.E. / Shankar, B.B. / Shih, N.Y. / Siddiqui, M.A. / Sun, J. / Tong, L. / Umland, S. / Wong, M.K. / Yang, D.Y. / Zhou, G. |
|---|
| 履歴 | | 登録 | 2009年12月10日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2010年3月2日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2021年10月13日 | Group: Database references / Derived calculations
カテゴリ: database_2 / pdbx_struct_conn_angle ...database_2 / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr2_auth_asym_id / _pdbx_struct_conn_angle.ptnr2_auth_seq_id / _pdbx_struct_conn_angle.ptnr2_label_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.3 | 2023年9月6日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  分子置換 / 解像度: 1.75 Å
分子置換 / 解像度: 1.75 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2010
ジャーナル: Bioorg.Med.Chem.Lett. / 年: 2010 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3l0v.cif.gz
3l0v.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3l0v.ent.gz
pdb3l0v.ent.gz PDB形式
PDB形式 3l0v.json.gz
3l0v.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 3l0v_validation.pdf.gz
3l0v_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 3l0v_full_validation.pdf.gz
3l0v_full_validation.pdf.gz 3l0v_validation.xml.gz
3l0v_validation.xml.gz 3l0v_validation.cif.gz
3l0v_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/l0/3l0v
https://data.pdbj.org/pub/pdb/validation_reports/l0/3l0v ftp://data.pdbj.org/pub/pdb/validation_reports/l0/3l0v
ftp://data.pdbj.org/pub/pdb/validation_reports/l0/3l0v リンク
リンク 集合体
集合体


 要素
要素 Homo sapiens (ヒト) / 遺伝子: ADAM17, CSVP, TACE / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: ADAM17, CSVP, TACE / 発現宿主:  Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P78536, ADAM 17 endopeptidase
Trichoplusia ni (イラクサキンウワバ) / 参照: UniProt: P78536, ADAM 17 endopeptidase X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.54178 Å
回転陽極 / タイプ: RIGAKU FR-E SUPERBRIGHT / 波長: 1.54178 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj