| 登録情報 | データベース: PDB / ID: 3hyg
|
|---|
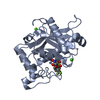
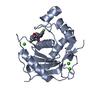
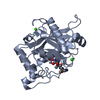
| タイトル | Crystal Structure of the Catalytic Domain of ADAMTS-5 in Complex with an Amino-2-indanol compound |
|---|
 要素 要素 | A disintegrin and metalloproteinase with thrombospondin motifs 5 |
|---|
 キーワード キーワード | HYDROLASE / alpha/beta structure / central five stranded beta-sheet / Cleavage on pair of basic residues / Disulfide bond / Extracellular matrix / Glycoprotein / Metal-binding / Metalloprotease / Polymorphism / Protease / Secreted / Zinc / Zymogen |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
Defective B3GALTL causes PpS / O-glycosylation of TSR domain-containing proteins / pulmonary valve morphogenesis / myoblast fusion / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; その他のペプチターゼ / extracellular matrix binding / aortic valve morphogenesis / negative regulation of cold-induced thermogenesis / endocardial cushion morphogenesis / extracellular matrix disassembly ...Defective B3GALTL causes PpS / O-glycosylation of TSR domain-containing proteins / pulmonary valve morphogenesis / myoblast fusion / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; その他のペプチターゼ / extracellular matrix binding / aortic valve morphogenesis / negative regulation of cold-induced thermogenesis / endocardial cushion morphogenesis / extracellular matrix disassembly / Degradation of the extracellular matrix / extracellular matrix organization / extracellular matrix / metalloendopeptidase activity / integrin binding / metallopeptidase activity / peptidase activity / heparin binding / endopeptidase activity / defense response to bacterium / endoplasmic reticulum lumen / proteolysis / extracellular space / extracellular region / zinc ion binding / identical protein binding類似検索 - 分子機能 Peptidase M12B, ADAM-TS5 / Thrombospondin type 1 domain / ADAMTS/ADAMTS-like, Spacer 1 / ADAMTS/ADAMTS-like / ADAMTS, cysteine-rich domain 2 / ADAMTS/ADAMTS-like, cysteine-rich domain 3 / : / ADAM-TS Spacer 1 / ADAMTS cysteine-rich domain 2 / ADAMTS cysteine-rich domain ...Peptidase M12B, ADAM-TS5 / Thrombospondin type 1 domain / ADAMTS/ADAMTS-like, Spacer 1 / ADAMTS/ADAMTS-like / ADAMTS, cysteine-rich domain 2 / ADAMTS/ADAMTS-like, cysteine-rich domain 3 / : / ADAM-TS Spacer 1 / ADAMTS cysteine-rich domain 2 / ADAMTS cysteine-rich domain / ADAM, cysteine-rich domain / ADAM Cysteine-Rich Domain / Reprolysin (M12B) family zinc metalloprotease / Peptidase M12B, ADAM/reprolysin / ADAM type metalloprotease domain profile. / Thrombospondin type 1 domain / Thrombospondin type-1 (TSP1) repeat superfamily / Thrombospondin type-1 (TSP1) repeat profile. / Thrombospondin type 1 repeats / Thrombospondin type-1 (TSP1) repeat / Collagenase (Catalytic Domain) / Collagenase (Catalytic Domain) / Metallopeptidase, catalytic domain superfamily / Neutral zinc metallopeptidases, zinc-binding region signature. / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 Chem-099 / A disintegrin and metalloproteinase with thrombospondin motifs 5類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 1.4 Å フーリエ合成 / 解像度: 1.4 Å |
|---|
 データ登録者 データ登録者 | Shieh, H.-S. / Williams, J.M. / Caspers, N. / Mathis, K.J. / Tortorella, M.D. / Tomasselli, A. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2009 ジャーナル: J.Biol.Chem. / 年: 2009
タイトル: Structural and inhibition analysis reveals the mechanism of selectivity of a series of aggrecanase inhibitors
著者: Tortorella, M.D. / Tomasselli, A.G. / Mathis, K.J. / Schnute, M.E. / Woodard, S.S. / Munie, G. / Williams, J.M. / Caspers, N. / Wittwer, A.J. / Malfait, A.M. / Shieh, H.S. |
|---|
| 履歴 | | 登録 | 2009年6月22日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2009年7月7日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2017年11月1日 | Group: Refinement description / カテゴリ: software |
|---|
| 改定 1.3 | 2021年10月13日 | Group: Database references / Derived calculations
カテゴリ: database_2 / struct_conn ...database_2 / struct_conn / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.4 | 2023年9月6日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
| 改定 1.5 | 2024年11月20日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 1.4 Å
フーリエ合成 / 解像度: 1.4 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2009
ジャーナル: J.Biol.Chem. / 年: 2009 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3hyg.cif.gz
3hyg.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3hyg.ent.gz
pdb3hyg.ent.gz PDB形式
PDB形式 3hyg.json.gz
3hyg.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 3hyg_validation.pdf.gz
3hyg_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 3hyg_full_validation.pdf.gz
3hyg_full_validation.pdf.gz 3hyg_validation.xml.gz
3hyg_validation.xml.gz 3hyg_validation.cif.gz
3hyg_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/hy/3hyg
https://data.pdbj.org/pub/pdb/validation_reports/hy/3hyg ftp://data.pdbj.org/pub/pdb/validation_reports/hy/3hyg
ftp://data.pdbj.org/pub/pdb/validation_reports/hy/3hyg リンク
リンク 集合体
集合体


 要素
要素 Homo sapiens (ヒト) / 遺伝子: ADAMTS-5, ADAMTS11, ADAMTS5, ADMP2 / プラスミド: PPHA79257 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: ADAMTS-5, ADAMTS11, ADAMTS5, ADMP2 / プラスミド: PPHA79257 / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 17-ID / 波長: 1 Å
/ ビームライン: 17-ID / 波長: 1 Å 解析
解析 フーリエ合成
フーリエ合成 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj










