| 登録情報 | データベース: PDB / ID: 3fit
|
|---|
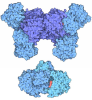
| タイトル | FHIT (FRAGILE HISTIDINE TRIAD PROTEIN) IN COMPLEX WITH ADENOSINE/SULFATE AMP ANALOG |
|---|
 要素 要素 | FRAGILE HISTIDINE PROTEIN |
|---|
 キーワード キーワード | COMPLEX (CHROMOSOMAL TRANSLOCATION/ADE) / FHIT / FRAGILE HISTIDINE TRIAD PROTEIN / PUTATIVE HUMAN TUMOR SUPPRESSOR / ADVANCED PHOTON SOURCE / APS / HIT PROTEIN FAMILY / PKCI / COMPLEX (CHROMOSOMAL TRANSLOCATION-ADE) / COMPLEX (CHROMOSOMAL TRANSLOCATION-ADE) complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
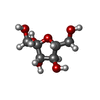
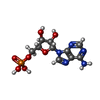
adenylylsulfate-ammonia adenylyltransferase / adenylylsulfatase / diadenosine triphosphate catabolic process / adenylylsulfate-ammonia adenylyltransferase activity / adenylylsulfatase activity / bis(5'-adenosyl)-triphosphatase / bis(5'-adenosyl)-triphosphatase activity / purine nucleotide metabolic process / 加水分解酵素; リン-窒素結合に作用; - / adenosine 5'-monophosphoramidase activity ...adenylylsulfate-ammonia adenylyltransferase / adenylylsulfatase / diadenosine triphosphate catabolic process / adenylylsulfate-ammonia adenylyltransferase activity / adenylylsulfatase activity / bis(5'-adenosyl)-triphosphatase / bis(5'-adenosyl)-triphosphatase activity / purine nucleotide metabolic process / 加水分解酵素; リン-窒素結合に作用; - / adenosine 5'-monophosphoramidase activity / intrinsic apoptotic signaling pathway by p53 class mediator / negative regulation of proteasomal ubiquitin-dependent protein catabolic process / fibrillar center / nucleotide binding / ubiquitin protein ligase binding / mitochondrion / identical protein binding / nucleus / plasma membrane / cytosol / cytoplasm類似検索 - 分子機能 : / FHIT family / HIT domain / Histidine triad, conserved site / HIT domain signature. / HIT domain profile. / HIT-like domain / HIT-like / HIT family, subunit A / HIT-like superfamily ...: / FHIT family / HIT domain / Histidine triad, conserved site / HIT domain signature. / HIT domain profile. / HIT-like domain / HIT-like / HIT family, subunit A / HIT-like superfamily / 2-Layer Sandwich / Alpha Beta類似検索 - ドメイン・相同性 ADENOSINE MONOPHOSPHATE / beta-D-fructofuranose / Bis(5'-adenosyl)-triphosphatase類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  多波長異常分散 / 解像度: 2.4 Å 多波長異常分散 / 解像度: 2.4 Å |
|---|
 データ登録者 データ登録者 | Lima, C.D. / D'Amico, K.L. / Naday, I. / Rosenbaum, G. / Westbrook, E.M. / Hendrickson, W.A. |
|---|
 引用 引用 |  ジャーナル: Structure / 年: 1997 ジャーナル: Structure / 年: 1997
タイトル: MAD analysis of FHIT, a putative human tumor suppressor from the HIT protein family.
著者: Lima, C.D. / D'Amico, K.L. / Naday, I. / Rosenbaum, G. / Westbrook, E.M. / Hendrickson, W.A. |
|---|
| 履歴 | | 登録 | 1997年5月17日 | 処理サイト: BNL |
|---|
| 改定 1.0 | 1997年11月19日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年3月25日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2020年7月29日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_conn / struct_ref_seq_dif / struct_site / struct_site_gen
Item: _chem_comp.name / _chem_comp.type ..._chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_ref_seq_dif.details
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 2.0 | 2024年5月29日 | Group: Advisory / Atomic model ...Advisory / Atomic model / Data collection / Database references / Derived calculations / Non-polymer description / Structure summary
カテゴリ: atom_site / chem_comp ...atom_site / chem_comp / chem_comp_atom / chem_comp_bond / database_2 / entity / pdbx_entity_nonpoly / pdbx_nonpoly_scheme / pdbx_unobs_or_zero_occ_atoms
Item: _atom_site.auth_comp_id / _atom_site.label_comp_id ..._atom_site.auth_comp_id / _atom_site.label_comp_id / _chem_comp.formula / _chem_comp.formula_weight / _chem_comp.id / _chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.pdbx_synonyms / _chem_comp.type / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _entity.pdbx_description / _pdbx_entity_nonpoly.comp_id / _pdbx_entity_nonpoly.name / _pdbx_nonpoly_scheme.mon_id / _pdbx_nonpoly_scheme.pdb_mon_id / _pdbx_unobs_or_zero_occ_atoms.auth_atom_id / _pdbx_unobs_or_zero_occ_atoms.auth_comp_id / _pdbx_unobs_or_zero_occ_atoms.label_atom_id / _pdbx_unobs_or_zero_occ_atoms.label_comp_id |
|---|
| 改定 2.1 | 2024年11月6日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  多波長異常分散 / 解像度: 2.4 Å
多波長異常分散 / 解像度: 2.4 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 1997
ジャーナル: Structure / 年: 1997 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3fit.cif.gz
3fit.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3fit.ent.gz
pdb3fit.ent.gz PDB形式
PDB形式 3fit.json.gz
3fit.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 3fit_validation.pdf.gz
3fit_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 3fit_full_validation.pdf.gz
3fit_full_validation.pdf.gz 3fit_validation.xml.gz
3fit_validation.xml.gz 3fit_validation.cif.gz
3fit_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/fi/3fit
https://data.pdbj.org/pub/pdb/validation_reports/fi/3fit ftp://data.pdbj.org/pub/pdb/validation_reports/fi/3fit
ftp://data.pdbj.org/pub/pdb/validation_reports/fi/3fit リンク
リンク 集合体
集合体

 要素
要素 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 19-ID / 波長: 0.9551
/ ビームライン: 19-ID / 波長: 0.9551  解析
解析 多波長異常分散 / 解像度: 2.4→8 Å / Isotropic thermal model: RESTRAINED / σ(F): 2
多波長異常分散 / 解像度: 2.4→8 Å / Isotropic thermal model: RESTRAINED / σ(F): 2  X-PLOR / バージョン: 3.1 / 分類: refinement
X-PLOR / バージョン: 3.1 / 分類: refinement ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj