+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 2plq | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal structure of the amidase from geobacillus pallidus RAPc8 | ||||||
 Components Components | Aliphatic amidase | ||||||
 Keywords Keywords | HYDROLASE / Nitrilase fold / alpha-beta-beta-alpha | ||||||
| Function / homology |  Function and homology information Function and homology information | ||||||
| Biological species |  Geobacillus pallidus (bacteria) Geobacillus pallidus (bacteria) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  MOLECULAR REPLACEMENT / Resolution: 1.9 Å MOLECULAR REPLACEMENT / Resolution: 1.9 Å | ||||||
 Authors Authors | Kimani, S.W. / Sewell, B.T. / Agarkar, V.B. / Sayed, M.F. / Cowan, D.A. | ||||||
 Citation Citation |  Journal: Acta Crystallogr.,Sect.F / Year: 2006 Journal: Acta Crystallogr.,Sect.F / Year: 2006Title: The quaternary structure of the amidase from Geobacillus pallidus RAPc8 is revealed by its crystal packing. Authors: Agarkar, V.B. / Kimani, S.W. / Cowan, D.A. / Sayed, M.F. / Sewell, B.T. #1:  Journal: Thesis / Year: 2007 Journal: Thesis / Year: 2007Title: The Crystal Structure of an aliphatic amidase from Geobacillus pallidus RAPc8 Authors: Kimani, S.W. #2:  Journal: To be Published Journal: To be PublishedTitle: The Crystal Structure of an aliphatic amidase from Geobacillus pallidus RAPc8 | ||||||
| History |
| ||||||
| Remark 999 | SEQUENCE The source organism is listed in GenBank entry AAO23013 and UNP entry Q9L543 as Bacillus ...SEQUENCE The source organism is listed in GenBank entry AAO23013 and UNP entry Q9L543 as Bacillus sp. It is correctly classified by its 16S RNA sequence as Geobacillus pallidus. |
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  2plq.cif.gz 2plq.cif.gz | 86.6 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb2plq.ent.gz pdb2plq.ent.gz | 64.4 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  2plq.json.gz 2plq.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/pl/2plq https://data.pdbj.org/pub/pdb/validation_reports/pl/2plq ftp://data.pdbj.org/pub/pdb/validation_reports/pl/2plq ftp://data.pdbj.org/pub/pdb/validation_reports/pl/2plq | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  1j31S S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 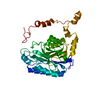
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | x 6
| |||||||||||||||||||||
| Unit cell |
| |||||||||||||||||||||
| Components on special symmetry positions |
| |||||||||||||||||||||
| Details | Four biological assemblies are generated by applying the space group symmetry operators. Our nomenclature A,B,C,D,E,F refers to a hexamer generated as follows: A -x, y, -z B -z+1/2, -y+1/2, -x+1/2 C y, z, x D -y+1/2, x+1/2, z+1/2 E z, -x, -y F x+1/2, -z+1/2, y+1/2 |
- Components
Components
| #1: Protein | Mass: 38640.832 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Geobacillus pallidus (bacteria) / Strain: RAPc8 / Gene: amiE, ami / Plasmid: pNH223 / Species (production host): Escherichia coli / Production host: Geobacillus pallidus (bacteria) / Strain: RAPc8 / Gene: amiE, ami / Plasmid: pNH223 / Species (production host): Escherichia coli / Production host:  |
|---|---|
| #2: Water | ChemComp-HOH / |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.41 Å3/Da / Density % sol: 49.62 % |
|---|---|
| Crystal grow | Temperature: 295 K / Method: vapor diffusion, hanging drop / pH: 5.6 Details: The purified enzyme was concentrated to 10 mg ml-1 and then crystallized with 1.2 M sodium citrate, 400 mM NaCl, 100 mM sodium acetate, pH 5.6, VAPOR DIFFUSION, HANGING DROP, temperature 295K |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: RIGAKU / Wavelength: 1.5418 ROTATING ANODE / Type: RIGAKU / Wavelength: 1.5418 |
| Detector | Type: RIGAKU RAXIS IV / Detector: IMAGE PLATE / Date: Nov 6, 2005 / Details: AXCO PX50 0.1mm focus |
| Radiation | Monochromator: Ni filter / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1.5418 Å / Relative weight: 1 |
| Reflection | Resolution: 1.9→50 Å / Num. obs: 30300 / % possible obs: 99.3 % / Observed criterion σ(I): 3 / Redundancy: 7.9 % / Biso Wilson estimate: 12.7 Å2 / Rmerge(I) obs: 0.111 / Χ2: 1.038 / Net I/σ(I): 8.6 |
| Reflection shell | Resolution: 1.9→1.97 Å / Redundancy: 3.9 % / Rmerge(I) obs: 0.315 / Mean I/σ(I) obs: 3.23 / Num. unique all: 2824 / Rsym value: 0.315 / Χ2: 0.591 / % possible all: 94.8 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 1j31 with non-identical side chains replaced by alanine. Resolution: 1.9→46.13 Å / Cor.coef. Fo:Fc: 0.959 / Cor.coef. Fo:Fc free: 0.942 / SU B: 2.104 / SU ML: 0.064 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.119 / ESU R Free: 0.111 / Stereochemistry target values: MAXIMUM LIKELIHOOD Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS. Density sufficient to accommodate two additional atoms connected to the sulfur of Cys 166 was observed in the active site. This density was ...Details: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS. Density sufficient to accommodate two additional atoms connected to the sulfur of Cys 166 was observed in the active site. This density was interpreted to indicate oxidation of the cysteine to sulfinic acid but this was not confirmed and co-ordinates of these atoms are not included in the deposition.
| ||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.4 Å / Solvent model: MASK | ||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 10.557 Å2 | ||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.9→46.13 Å
| ||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 1.9→1.95 Å / Total num. of bins used: 20
|
 Movie
Movie Controller
Controller











 PDBj
PDBj
