| 登録情報 | データベース: PDB / ID: 2osb
|
|---|
| タイトル | Crystal structure of a thermostable mutant of Bacillus subtilis Adenylate Kinase (Q16L/Q199R/) |
|---|
 要素 要素 | Adenylate kinase |
|---|
 キーワード キーワード | TRANSFERASE / thermostability / adenylate kinase / experimental adaptive evolution / directed evolution |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
nucleoside monophosphate metabolic process / nucleoside diphosphate metabolic process / adenylate kinase / AMP kinase activity / AMP salvage / nucleoside diphosphate kinase activity / zinc ion binding / ATP binding / cytoplasm / cytosol類似検索 - 分子機能 Adenylate kinase, active site lid domain / Adenylate kinase, active site lid / Adenylate kinase subfamily / Adenylate kinase, conserved site / Adenylate kinase signature. / Adenylate kinase/UMP-CMP kinase / Adenylate kinase / P-loop containing nucleotide triphosphate hydrolases / Rossmann fold / P-loop containing nucleoside triphosphate hydrolase ...Adenylate kinase, active site lid domain / Adenylate kinase, active site lid / Adenylate kinase subfamily / Adenylate kinase, conserved site / Adenylate kinase signature. / Adenylate kinase/UMP-CMP kinase / Adenylate kinase / P-loop containing nucleotide triphosphate hydrolases / Rossmann fold / P-loop containing nucleoside triphosphate hydrolase / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 BIS(ADENOSINE)-5'-PENTAPHOSPHATE / Adenylate kinase類似検索 - 構成要素 |
|---|
| 生物種 |   Bacillus subtilis (枯草菌) Bacillus subtilis (枯草菌) |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å |
|---|
 データ登録者 データ登録者 | Myers, J. / Counago, R. / Wilson, C.J. / Wu, G. / Shamoo, Y. |
|---|
 引用 引用 |  ジャーナル: To be Published ジャーナル: To be Published
タイトル: Crystal structure of a thermostable mutant of Bacillus subtilis Adenylate Kinase (Q16L/Q199R/)
著者: Counago, R. / Wilson, C.J. / Myers, J. / Wu, G. / Shamoo, Y. / Wittung-Stafshede, P. |
|---|
| 履歴 | | 登録 | 2007年2月5日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2008年1月15日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2017年10月18日 | Group: Refinement description / カテゴリ: software |
|---|
| 改定 1.3 | 2021年10月20日 | Group: Database references / Derived calculations
カテゴリ: database_2 / struct_conn ...database_2 / struct_conn / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.4 | 2023年8月30日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  分子置換 / 解像度: 1.8 Å
分子置換 / 解像度: 1.8 Å  データ登録者
データ登録者 引用
引用 ジャーナル: To be Published
ジャーナル: To be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2osb.cif.gz
2osb.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2osb.ent.gz
pdb2osb.ent.gz PDB形式
PDB形式 2osb.json.gz
2osb.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/os/2osb
https://data.pdbj.org/pub/pdb/validation_reports/os/2osb ftp://data.pdbj.org/pub/pdb/validation_reports/os/2osb
ftp://data.pdbj.org/pub/pdb/validation_reports/os/2osb
 リンク
リンク 集合体
集合体

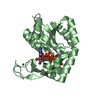
 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU / 波長: 1.5418 Å
回転陽極 / タイプ: RIGAKU / 波長: 1.5418 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj