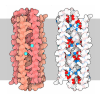
登録情報 データベース : PDB / ID : 2ny5タイトル HIV-1 gp120 Envelope Glycoprotein (M95W, W96C, I109C, T257S, V275C, S334A, S375W, Q428C, A433M) Complexed with CD4 and Antibody 17b (ANTIBODY 17B, ...) x 2 ENVELOPE GLYCOPROTEIN GP120 T-cell surface glycoprotein CD4 キーワード / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 2.5 Å データ登録者 Zhou, T. / Xu, L. / Dey, B. / Hessell, A.J. / Van Ryk, D. / Xiang, S.H. / Yang, X. / Zhang, M.Y. / Zwick, M.B. / Arthos, J. ...Zhou, T. / Xu, L. / Dey, B. / Hessell, A.J. / Van Ryk, D. / Xiang, S.H. / Yang, X. / Zhang, M.Y. / Zwick, M.B. / Arthos, J. / Burton, D.R. / Dimitrov, D.S. / Sodroski, J. / Wyatt, R. / Nabel, G.J. / Kwong, P.D. ジャーナル : Nature / 年 : 2007タイトル : Structural definition of a conserved neutralization epitope on HIV-1 gp120.著者 : Zhou, T. / Xu, L. / Dey, B. / Hessell, A.J. / Van Ryk, D. / Xiang, S.H. / Yang, X. / Zhang, M.Y. / Zwick, M.B. / Arthos, J. / Burton, D.R. / Dimitrov, D.S. / Sodroski, J. / Wyatt, R. / Nabel, G.J. / Kwong, P.D. 履歴 登録 2006年11月20日 登録サイト / 処理サイト 改定 1.0 2007年2月6日 Provider / タイプ 改定 1.1 2008年5月1日 Group 改定 1.2 2011年7月13日 Group / Version format compliance改定 1.3 2017年10月18日 Group / カテゴリ Item _software.classification / _software.contact_author ... _software.classification / _software.contact_author / _software.contact_author_email / _software.date / _software.language / _software.location / _software.name / _software.type / _software.version 改定 2.0 2020年7月29日 Group Atomic model / Data collection ... Atomic model / Data collection / Database references / Derived calculations / Non-polymer description / Structure summary カテゴリ atom_site / atom_site_anisotrop ... atom_site / atom_site_anisotrop / chem_comp / entity / entity_name_com / pdbx_branch_scheme / pdbx_chem_comp_identifier / pdbx_entity_branch / pdbx_entity_branch_descriptor / pdbx_entity_branch_link / pdbx_entity_branch_list / pdbx_entity_nonpoly / pdbx_molecule_features / pdbx_nonpoly_scheme / struct_asym / struct_conn / struct_ref_seq_dif Item _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ... _atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_asym_id / _atom_site.auth_atom_id / _atom_site.auth_comp_id / _atom_site.auth_seq_id / _atom_site.label_asym_id / _atom_site.label_atom_id / _atom_site.label_comp_id / _atom_site.label_entity_id / _atom_site.type_symbol / _atom_site_anisotrop.id / _atom_site_anisotrop.pdbx_label_asym_id / _chem_comp.formula / _chem_comp.formula_weight / _chem_comp.id / _chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _entity.formula_weight / _entity.pdbx_description / _entity.pdbx_number_of_molecules / _entity.src_method / _entity.type / _struct_asym.entity_id / _struct_ref_seq_dif.details 解説 / Provider / タイプ 改定 2.1 2023年8月30日 Group Data collection / Database references ... Data collection / Database references / Refinement description / Structure summary カテゴリ chem_comp / chem_comp_atom ... chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_DOI / _database_2.pdbx_database_accession改定 2.2 2024年11月13日 Group カテゴリ / pdbx_modification_feature
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.5 Å
分子置換 / 解像度: 2.5 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nature / 年: 2007
ジャーナル: Nature / 年: 2007 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2ny5.cif.gz
2ny5.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2ny5.ent.gz
pdb2ny5.ent.gz PDB形式
PDB形式 2ny5.json.gz
2ny5.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2ny5_validation.pdf.gz
2ny5_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2ny5_full_validation.pdf.gz
2ny5_full_validation.pdf.gz 2ny5_validation.xml.gz
2ny5_validation.xml.gz 2ny5_validation.cif.gz
2ny5_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ny/2ny5
https://data.pdbj.org/pub/pdb/validation_reports/ny/2ny5 ftp://data.pdbj.org/pub/pdb/validation_reports/ny/2ny5
ftp://data.pdbj.org/pub/pdb/validation_reports/ny/2ny5 リンク
リンク 集合体
集合体
 要素
要素
 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Homo sapiens (ヒト) / 参照: UniProt: Q71057, UniProt: P19551*PLUS
Homo sapiens (ヒト) / 参照: UniProt: Q71057, UniProt: P19551*PLUS Homo sapiens (ヒト) / 遺伝子: CD4 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: CD4 / 発現宿主: 
 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト) / 参照: UniProt: Q6P5S8
Homo sapiens (ヒト) / 参照: UniProt: Q6P5S8 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト) / 参照: UniProt: Q6PJA4
Homo sapiens (ヒト) / 参照: UniProt: Q6PJA4

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-ID / 波長: 0.9794
/ ビームライン: 22-ID / 波長: 0.9794  解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj