| 登録情報 | データベース: PDB / ID: 1yah
|
|---|
| タイトル | Crystal Structure of Human Liver Carboxylesterase complexed to Etyl Acetate; A Fatty Acid Ethyl Ester Analogue |
|---|
 要素 要素 | CES1 protein |
|---|
 キーワード キーワード | HYDROLASE / Carboxylesterase / Ethyl Acetate / Fatty Acid Acyl Ester |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
cholesterol ester hydrolysis involved in cholesterol transport / methylumbelliferyl-acetate deacetylase / methylumbelliferyl-acetate deacetylase activity / regulation of bile acid secretion / sterol esterase / sterol ester esterase activity / medium-chain fatty acid metabolic process / carboxylesterase / Physiological factors / carboxylesterase activity ...cholesterol ester hydrolysis involved in cholesterol transport / methylumbelliferyl-acetate deacetylase / methylumbelliferyl-acetate deacetylase activity / regulation of bile acid secretion / sterol esterase / sterol ester esterase activity / medium-chain fatty acid metabolic process / carboxylesterase / Physiological factors / carboxylesterase activity / regulation of bile acid biosynthetic process / cellular response to cholesterol / positive regulation of cholesterol metabolic process / reverse cholesterol transport / Phase I - Functionalization of compounds / carboxylic ester hydrolase activity / cholesterol biosynthetic process / Aspirin ADME / negative regulation of cholesterol storage / cellular response to low-density lipoprotein particle stimulus / positive regulation of cholesterol efflux / cholesterol metabolic process / Metabolism of Angiotensinogen to Angiotensins / lipid catabolic process / lipid droplet / epithelial cell differentiation / cholesterol homeostasis / response to toxic substance / endoplasmic reticulum lumen / endoplasmic reticulum / cytoplasm / cytosol類似検索 - 分子機能 : / Carboxylesterase type B, active site / Carboxylesterases type-B serine active site. / Carboxylesterase type B, conserved site / Carboxylesterases type-B signature 2. / Carboxylesterase, type B / Carboxylesterase family / Alpha/Beta hydrolase fold, catalytic domain / Alpha/Beta hydrolase fold / Rossmann fold ...: / Carboxylesterase type B, active site / Carboxylesterases type-B serine active site. / Carboxylesterase type B, conserved site / Carboxylesterases type-B signature 2. / Carboxylesterase, type B / Carboxylesterase family / Alpha/Beta hydrolase fold, catalytic domain / Alpha/Beta hydrolase fold / Rossmann fold / 3-Layer(aba) Sandwich / Alpha Beta類似検索 - ドメイン・相同性 ETHYL ACETATE / N-acetyl-alpha-neuraminic acid / Liver carboxylesterase 1類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 3 Å 分子置換 / 解像度: 3 Å |
|---|
 データ登録者 データ登録者 | Fleming, C.D. / Bencahrit, S. / Edwards, C.C. / Hyatt, J.L. / Morton, C.L. / Howard-Williams, E.L. / Potter, P.M. / Redinbo, M.R. |
|---|
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2005 ジャーナル: J.Mol.Biol. / 年: 2005
タイトル: Structural insights into drug processing by human carboxylesterase 1: tamoxifen, mevastatin, and inhibition by benzil.
著者: Fleming, C.D. / Bencharit, S. / Edwards, C.C. / Hyatt, J.L. / Tsurkan, L. / Bai, F. / Fraga, C. / Morton, C.L. / Howard-Williams, E.L. / Potter, P.M. / Redinbo, M.R. |
|---|
| 履歴 | | 登録 | 2004年12月17日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2005年8月2日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月30日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Non-polymer description / Version format compliance |
|---|
| 改定 1.3 | 2020年7月29日 | Group: Data collection / Derived calculations / Structure summary
カテゴリ: chem_comp / entity ...chem_comp / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / struct_conn / struct_site / struct_site_gen
Item: _chem_comp.name / _chem_comp.type ..._chem_comp.name / _chem_comp.type / _entity.pdbx_description / _pdbx_entity_nonpoly.name / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_role
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 1.4 | 2023年8月23日 | Group: Data collection / Database references ...Data collection / Database references / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 1.5 | 2024年10月9日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 3 Å
分子置換 / 解像度: 3 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Mol.Biol. / 年: 2005
ジャーナル: J.Mol.Biol. / 年: 2005 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1yah.cif.gz
1yah.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1yah.ent.gz
pdb1yah.ent.gz PDB形式
PDB形式 1yah.json.gz
1yah.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1yah_validation.pdf.gz
1yah_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1yah_full_validation.pdf.gz
1yah_full_validation.pdf.gz 1yah_validation.xml.gz
1yah_validation.xml.gz 1yah_validation.cif.gz
1yah_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ya/1yah
https://data.pdbj.org/pub/pdb/validation_reports/ya/1yah ftp://data.pdbj.org/pub/pdb/validation_reports/ya/1yah
ftp://data.pdbj.org/pub/pdb/validation_reports/ya/1yah リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト)
Homo sapiens (ヒト)

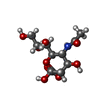


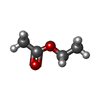



 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRL
SSRL  / ビームライン: BL9-1 / 波長: 1.1 Å
/ ビームライン: BL9-1 / 波長: 1.1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー





















 PDBj
PDBj