+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1g9m | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
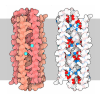
| タイトル | HIV-1 HXBC2 GP120 ENVELOPE GLYCOPROTEIN COMPLEXED WITH CD4 AND INDUCED NEUTRALIZING ANTIBODY 17B | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | Viral protein/Immune system / COMPLEX (HIV ENVELOPE PROTEIN-CD4-FAB) / HIV-1 EXTERIOR ENVELOPE GP120 FROM LABORATORY-ADAPTED ISOLATE / HXBC2 / SURFACE T-CELL GLYCOPROTEIN CD4 / ANTIGEN-BINDING FRAGMENT OF HUMAN IMMUNOGLOBULIN 17B / Viral protein-Immune system COMPLEX | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報helper T cell enhancement of adaptive immune response / interleukin-16 binding / interleukin-16 receptor activity / response to methamphetamine hydrochloride / maintenance of protein location in cell / cellular response to ionomycin / T cell selection / Synthesis and processing of ENV and VPU / symbiont-mediated evasion of host immune response / MHC class II protein binding ...helper T cell enhancement of adaptive immune response / interleukin-16 binding / interleukin-16 receptor activity / response to methamphetamine hydrochloride / maintenance of protein location in cell / cellular response to ionomycin / T cell selection / Synthesis and processing of ENV and VPU / symbiont-mediated evasion of host immune response / MHC class II protein binding / positive regulation of kinase activity / cellular response to granulocyte macrophage colony-stimulating factor stimulus / interleukin-15-mediated signaling pathway / positive regulation of establishment of T cell polarity / positive regulation of monocyte differentiation / Nef Mediated CD4 Down-regulation / Alpha-defensins / regulation of T cell activation / response to vitamin D / extracellular matrix structural constituent / Other interleukin signaling / T cell receptor complex / enzyme-linked receptor protein signaling pathway / Dectin-2 family / Translocation of ZAP-70 to Immunological synapse / Phosphorylation of CD3 and TCR zeta chains / positive regulation of protein kinase activity / regulation of calcium ion transport / positive regulation of calcium ion transport into cytosol / macrophage differentiation / Generation of second messenger molecules / immunoglobulin binding / T cell differentiation / Co-inhibition by PD-1 / Binding and entry of HIV virion / coreceptor activity / positive regulation of plasma membrane raft polarization / positive regulation of receptor clustering / positive regulation of T cell proliferation / positive regulation of interleukin-2 production / positive regulation of calcium-mediated signaling / cell surface receptor protein tyrosine kinase signaling pathway / protein tyrosine kinase binding / actin filament organization / host cell endosome membrane / Vpu mediated degradation of CD4 / clathrin-coated endocytic vesicle membrane / Assembly Of The HIV Virion / calcium-mediated signaling / Budding and maturation of HIV virion / positive regulation of protein phosphorylation / MHC class II protein complex binding / transmembrane signaling receptor activity / Downstream TCR signaling / response to estradiol / Cargo recognition for clathrin-mediated endocytosis / signaling receptor activity / Clathrin-mediated endocytosis / virus receptor activity / response to ethanol / defense response to Gram-negative bacterium / clathrin-dependent endocytosis of virus by host cell / adaptive immune response / early endosome / positive regulation of viral entry into host cell / cell surface receptor signaling pathway / positive regulation of ERK1 and ERK2 cascade / positive regulation of canonical NF-kappaB signal transduction / cell adhesion / positive regulation of MAPK cascade / viral protein processing / immune response / receptor ligand activity / membrane raft / endoplasmic reticulum lumen / fusion of virus membrane with host plasma membrane / external side of plasma membrane / fusion of virus membrane with host endosome membrane / viral envelope / lipid binding / symbiont entry into host cell / protein kinase binding / endoplasmic reticulum membrane / positive regulation of DNA-templated transcription / virion attachment to host cell / host cell plasma membrane / virion membrane / structural molecule activity / enzyme binding / signal transduction / protein homodimerization activity / zinc ion binding / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / THIS DEPOSIT IS THE REFINEMENT OF THE PREVIOUSLY DETERMINED 1GC1 STRUCTURE / 解像度: 2.2 Å シンクロトロン / THIS DEPOSIT IS THE REFINEMENT OF THE PREVIOUSLY DETERMINED 1GC1 STRUCTURE / 解像度: 2.2 Å | |||||||||
 データ登録者 データ登録者 | Kwong, P.D. / Wyatt, R. / Majeed, S. / Robinson, J. / Sweet, R.W. / Sodroski, J. / Hendrickson, W.A. | |||||||||
 引用 引用 |  ジャーナル: Structure Fold.Des. / 年: 2000 ジャーナル: Structure Fold.Des. / 年: 2000タイトル: Structures of HIV-1 gp120 envelope glycoproteins from laboratory-adapted and primary isolates. 著者: Kwong, P.D. / Wyatt, R. / Majeed, S. / Robinson, J. / Sweet, R.W. / Sodroski, J. / Hendrickson, W.A. #1:  ジャーナル: Nature / 年: 1998 ジャーナル: Nature / 年: 1998タイトル: Structure of an HIV gp120 Envelope Glycoprotein in Complex with the CD4 Receptor and a Neutralizing Human Antibody 著者: Kwong, P.D. / Wyatt, R. / Robinson, J. / Sweet, R.W. / Sodroski, J. / Hendrickson, W.A. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1g9m.cif.gz 1g9m.cif.gz | 227.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1g9m.ent.gz pdb1g9m.ent.gz | 176.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1g9m.json.gz 1g9m.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1g9m_validation.pdf.gz 1g9m_validation.pdf.gz | 514.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1g9m_full_validation.pdf.gz 1g9m_full_validation.pdf.gz | 559.2 KB | 表示 | |
| XML形式データ |  1g9m_validation.xml.gz 1g9m_validation.xml.gz | 26.9 KB | 表示 | |
| CIF形式データ |  1g9m_validation.cif.gz 1g9m_validation.cif.gz | 44.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/g9/1g9m https://data.pdbj.org/pub/pdb/validation_reports/g9/1g9m ftp://data.pdbj.org/pub/pdb/validation_reports/g9/1g9m ftp://data.pdbj.org/pub/pdb/validation_reports/g9/1g9m | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 2種, 2分子 GC
| #1: タンパク質 | 分子量: 35429.094 Da / 分子数: 1 / 断片: CORE / 変異: VARIABLE LOOPS SUBSTITUTED / 由来タイプ: 組換発現 由来: (組換発現)   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)属: Lentivirus / 株: CLADE B 解説: SECRETED FROM DROSOPHILA SCHNEIDER 2 LINES UNDER CONTROL OF AN INDUCIBLE METALL OTHIONEIN PROMOTER Variant: LABORATORY-ADAPTED ISOLATE HXBC2 発現宿主:  参照: UniProt: P04578 |
|---|---|
| #2: タンパク質 | 分子量: 20503.260 Da / 分子数: 1 / 断片: D1D2, N-TERMINAL TWO DOMAIN FRAGMENT / 変異: S184N, I185T / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / Cell (発現宿主): OVARY CELLS (CHO) Homo sapiens (ヒト) / Cell (発現宿主): OVARY CELLS (CHO)発現宿主:  参照: UniProt: P01730 |
-抗体 , 2種, 2分子 LH
| #3: 抗体 | 分子量: 23439.961 Da / 分子数: 1 / 断片: ANTIGEN-BINDING FRAGMENT, FAB / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) Homo sapiens (ヒト)解説: EPSTEIN-BARR VIRUS IMMORTALIZED B-CELL CLONE FUSED WITH A MURINE B-CELL FUSION PARTNER 発現宿主:  |
|---|---|
| #4: 抗体 | 分子量: 24525.578 Da / 分子数: 1 / 断片: ANTIGEN-BINDING FRAGMENT, FAB / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) Homo sapiens (ヒト)解説: EPSTEIN-BARR VIRUS IMMORTALIZED B-CELL CLONE FUSED WITH A MURINE B-CELL FUSION PARTNER 発現宿主:  |
-糖 , 2種, 14分子 
| #5: 多糖 | | #6: 糖 | ChemComp-NAG / |
|---|
-非ポリマー , 2種, 954分子 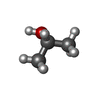


| #7: 化合物 | ChemComp-IPA / |
|---|---|
| #8: 水 | ChemComp-HOH / |
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3 Å3/Da / 溶媒含有率: 59 % | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 6.4 詳細: VAPOUR DIFFUSION CRYSTALLIZATION: 0.5 UL OF PROTEIN (~10MG/ML IN 350 MM NACL, 5 MM TRISCL PH 7.0) + 0.4 UL OF 0.1 M NACITRATE, 0.02 M NAHEPES, 10% ISOPROPANOL, 10.5% MONOMETHYL-PEG 5000, 0. ...詳細: VAPOUR DIFFUSION CRYSTALLIZATION: 0.5 UL OF PROTEIN (~10MG/ML IN 350 MM NACL, 5 MM TRISCL PH 7.0) + 0.4 UL OF 0.1 M NACITRATE, 0.02 M NAHEPES, 10% ISOPROPANOL, 10.5% MONOMETHYL-PEG 5000, 0.0075% SEAPREP AGAROSE, PH 6.4 OVER A RESERVOIR OF 0.35 M NACL, 0.1 M NACITRATE, 0.02 M NAHEPES, 10% ISOPROPANOL, 10.5% MONOMETHYL-PEG 5000, PH 6.4, VAPOR DIFFUSION, HANGING DROP, temperature 293K | |||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  NSLS NSLS  / ビームライン: X4A / 波長: 0.97953 Å / ビームライン: X4A / 波長: 0.97953 Å |
| 検出器 | タイプ: FUJI / 検出器: IMAGE PLATE / 日付: 1996年5月25日 |
| 放射 | モノクロメーター: silicon crystal / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.97953 Å / 相対比: 1 |
| 反射 | 解像度: 2.2→20 Å / Num. all: 138810 / Num. obs: 56183 / % possible obs: 87.7 % / Observed criterion σ(F): 0 / Observed criterion σ(I): -0.35 / 冗長度: 2.47 % / Biso Wilson estimate: 17.5 Å2 / Rmerge(I) obs: 0.145 / Rsym value: 0.145 / Net I/σ(I): 5.33 |
| 反射 シェル | 解像度: 2.2→2.28 Å / 冗長度: 1.6 % / Rmerge(I) obs: 0.382 / Mean I/σ(I) obs: 2.1 / Num. unique all: 4207 / Rsym value: 0.382 / % possible all: 66.3 |
| 反射 シェル | *PLUS % possible obs: 66.3 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法: THIS DEPOSIT IS THE REFINEMENT OF THE PREVIOUSLY DETERMINED 1GC1 STRUCTURE 開始モデル: pdb entry 1gc1 解像度: 2.2→20 Å / Rfactor Rfree error: 0.005 / Isotropic thermal model: Isotropic / 交差検証法: THROUGHOUT / σ(F): 0 / σ(I): 0 / 立体化学のターゲット値: Engh & Huber 詳細: OVERALL ANISOTROPIC B VALUE CORRECTION APPLIED TO DATA DURING CNS REFINEMENT
| ||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 溶媒モデル: flat model / Bsol: 52.7663 Å2 / ksol: 0.305424 e/Å3 | ||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 31.5 Å2
| ||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.2→20 Å
| ||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.2→2.21 Å / Rfactor Rfree error: 0.058 / Total num. of bins used: 50
| ||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: CNS / 分類: refinement | ||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj