[English] 日本語
 Yorodumi
Yorodumi- PDB-192l: A HELIX INITIATION SIGNAL IN T4 LYSOZYME IDENTIFIED BY POLYALANIN... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 192l | ||||||
|---|---|---|---|---|---|---|---|
| Title | A HELIX INITIATION SIGNAL IN T4 LYSOZYME IDENTIFIED BY POLYALANINE MUTAGENESIS | ||||||
 Components Components | LYSOZYME | ||||||
 Keywords Keywords | HYDROLASE (O-GLYCOSYL) | ||||||
| Function / homology |  Function and homology information Function and homology informationviral release from host cell by cytolysis / peptidoglycan catabolic process / cell wall macromolecule catabolic process / lysozyme / lysozyme activity / host cell cytoplasm / defense response to bacterium Similarity search - Function | ||||||
| Biological species |  Enterobacteria phage T4 (virus) Enterobacteria phage T4 (virus) | ||||||
| Method |  X-RAY DIFFRACTION / Resolution: 1.9 Å X-RAY DIFFRACTION / Resolution: 1.9 Å | ||||||
 Authors Authors | Zhang, X.-J. / Matthews, B.W. | ||||||
 Citation Citation |  Journal: Biophys.Chem. / Year: 2002 Journal: Biophys.Chem. / Year: 2002Title: A helix initiation signal in T4 lysozyme identified by polyalanine mutagenesis. Authors: Zhang, X.J. / Baase, W.A. / Matthews, B.W. #1:  Journal: J.Mol.Biol. / Year: 1987 Journal: J.Mol.Biol. / Year: 1987Title: Structure of Bacteriophage T4 Lysozyme Refined at 1.7 Angstroms Resolution Authors: Weaver, L.H. / Matthews, B.W. #2:  Journal: Biochemistry / Year: 1991 Journal: Biochemistry / Year: 1991Title: Toward a Simplification of the Protein Folding Problem: A Stabilizing Polyalanine Alpha-Helix Engineered in T4 Lysozyme Authors: Zhang, X.-J. / Baase, W.A. / Matthews, B.W. #3:  Journal: J.Mol.Biol. / Year: 1978 Journal: J.Mol.Biol. / Year: 1978Title: Structure of the Lysozyme from Bacteriophage T4, an Electron Density Map at 2.4 Angstroms Resolution Authors: Remington, S.J. / Anderson, W.F. / Owen, J. / Ten Eyck, L.F. / Grainger, C.T. / Matthews, B.W. | ||||||
| History |
| ||||||
| Remark 700 | SHEET THERE ARE SEVERAL SUBTLE ASPECTS OF THE SECONDARY STRUCTURE OF THIS MOLECULE WHICH CANNOT ...SHEET THERE ARE SEVERAL SUBTLE ASPECTS OF THE SECONDARY STRUCTURE OF THIS MOLECULE WHICH CANNOT CONVENIENTLY BE REPRESENTED IN THE HELIX AND SHEET RECORDS BELOW. THESE ASPECTS INFLUENCE THE REPRESENTATION OF HELIX 6 AND STRAND 3 OF SHEET *S1*. THE PAPER CITED AS REFERENCE 3 ABOVE SHOULD BE CONSULTED FOR THESE SUBTLETIES. |
- Structure visualization
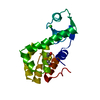
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  192l.cif.gz 192l.cif.gz | 47.4 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb192l.ent.gz pdb192l.ent.gz | 33.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  192l.json.gz 192l.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/92/192l https://data.pdbj.org/pub/pdb/validation_reports/92/192l ftp://data.pdbj.org/pub/pdb/validation_reports/92/192l ftp://data.pdbj.org/pub/pdb/validation_reports/92/192l | HTTPS FTP |
|---|
-Related structure data
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 18236.064 Da / Num. of mol.: 1 Mutation: N40A, S44A, E45A, D47A, K48A, C54T, C97A, D127A, E128A, V131A, N132A Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Enterobacteria phage T4 (virus) / Genus: T4-like viruses / Species: Enterobacteria phage T4 sensu lato / Gene: T4 LYSOZYME GENE / Plasmid: pHN1403 / Cell line (production host): RR1 / Production host: Enterobacteria phage T4 (virus) / Genus: T4-like viruses / Species: Enterobacteria phage T4 sensu lato / Gene: T4 LYSOZYME GENE / Plasmid: pHN1403 / Cell line (production host): RR1 / Production host:  | ||||
|---|---|---|---|---|---|
| #2: Chemical | | #3: Chemical | ChemComp-HED / | #4: Water | ChemComp-HOH / | |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION X-RAY DIFFRACTION |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.81 Å3/Da / Density % sol: 56.22 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Crystal grow | *PLUS Method: vapor diffusion / Details: A.E. Eriksson, (1993) J. Mol. Biol., 229, 747. / PH range low: 7.1 / PH range high: 6.3 | ||||||||||||||||||||||||||||||
| Components of the solutions | *PLUS
|
-Data collection
| Diffraction | Ambient pressure: 101 kPa / Mean temperature: 298 K |
|---|---|
| Diffraction source | Source:  ROTATING ANODE / Type: ELLIOTT GX-21 / Target: Cu / Voltage: 40 kV ROTATING ANODE / Type: ELLIOTT GX-21 / Target: Cu / Voltage: 40 kV |
| Detector | Type: OSCILLATION CAMERA / Detector: FILM / Details: Kodak No-Screen X-ray film |
| Radiation | Monochromator: graphite / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray / Wavelength: 1.5418 Å |
| Radiation wavelength | Relative weight: 1 |
| Reflection | *PLUS Highest resolution: 1.9 Å / % possible obs: 66 % / Rmerge(I) obs: 0.076 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Resolution: 1.9→6 Å Details: RESIDUES 162 - 164 IN WILD-TYPE AND ALL MUTANT LYSOZYMES THAT CRYSTALIZED IN THE WILD-TYPE CRYSTAL (P32 2 1) CRYSTAL FORM ARE EXTREMELY MOBILE. THUS THE COORDINATES FOR THESE RESIDUES ARE ...Details: RESIDUES 162 - 164 IN WILD-TYPE AND ALL MUTANT LYSOZYMES THAT CRYSTALIZED IN THE WILD-TYPE CRYSTAL (P32 2 1) CRYSTAL FORM ARE EXTREMELY MOBILE. THUS THE COORDINATES FOR THESE RESIDUES ARE VERY UNRELIABLE (IF INCLUDED). RESIDUES 162 - 164 IN WILD-TYPE AND ALL MUTANT LYSOZYMES ARE EXTREMELY MOBILE. THUS THE COORDINATES FOR THESE RESIDUES ARE VERY UNRELIABLE.
| ||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.9→6 Å
| ||||||||||||||||||||||||||||||
| Refine LS restraints |
|
 Movie
Movie Controller
Controller























 PDBj
PDBj