+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9973 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Undocked hemichannel of an N-terminal deletion mutant of INX-6 in a nanodisc | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Gap junctions / Innexin / TRANSPORT PROTEIN | ||||||||||||
| 機能・相同性 | gap junction hemi-channel activity / Innexin / Innexin / Pannexin family profile. / gap junction / gap junction channel activity / monoatomic ion transmembrane transport / plasma membrane / Innexin-6 機能・相同性情報 機能・相同性情報 | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | ||||||||||||
 データ登録者 データ登録者 | Burendei B / Shinozaki R | ||||||||||||
| 資金援助 |  日本, 3件 日本, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2020 ジャーナル: Sci Adv / 年: 2020タイトル: Cryo-EM structures of undocked innexin-6 hemichannels in phospholipids. 著者: Batuujin Burendei / Ruriko Shinozaki / Masakatsu Watanabe / Tohru Terada / Kazutoshi Tani / Yoshinori Fujiyoshi / Atsunori Oshima /  要旨: Gap junctions form intercellular conduits with a large pore size whose closed and open states regulate communication between adjacent cells. The structural basis of the mechanism by which gap ...Gap junctions form intercellular conduits with a large pore size whose closed and open states regulate communication between adjacent cells. The structural basis of the mechanism by which gap junctions close, however, remains uncertain. Here, we show the cryo-electron microscopy structures of innexin-6 (INX-6) gap junction proteins in an undocked hemichannel form. In the nanodisc-reconstituted structure of the wild-type INX-6 hemichannel, flat double-layer densities obstruct the channel pore. Comparison of the hemichannel structures of a wild-type INX-6 in detergent and nanodisc-reconstituted amino-terminal deletion mutant reveals that lipid-mediated amino-terminal rearrangement and pore obstruction occur upon nanodisc reconstitution. Together with molecular dynamics simulations and electrophysiology functional assays, our results provide insight into the closure of the INX-6 hemichannel in a lipid bilayer before docking of two hemichannels. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9973.map.gz emd_9973.map.gz | 20.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9973-v30.xml emd-9973-v30.xml emd-9973.xml emd-9973.xml | 13.1 KB 13.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_9973_fsc.xml emd_9973_fsc.xml | 6.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_9973.png emd_9973.png | 248.3 KB | ||
| Filedesc metadata |  emd-9973.cif.gz emd-9973.cif.gz | 5.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9973 http://ftp.pdbj.org/pub/emdb/structures/EMD-9973 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9973 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9973 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_9973_validation.pdf.gz emd_9973_validation.pdf.gz | 615.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_9973_full_validation.pdf.gz emd_9973_full_validation.pdf.gz | 614.9 KB | 表示 | |
| XML形式データ |  emd_9973_validation.xml.gz emd_9973_validation.xml.gz | 9.1 KB | 表示 | |
| CIF形式データ |  emd_9973_validation.cif.gz emd_9973_validation.cif.gz | 11.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9973 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9973 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9973 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9973 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6kfhMC  9971C  9972C  6kffC  6kfgC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10291 (タイトル: Structure of an undocked hemichannel of the N-terminal-deleted INX-6 in a nanodisc EMPIAR-10291 (タイトル: Structure of an undocked hemichannel of the N-terminal-deleted INX-6 in a nanodiscData size: 15.9 Data #1: Structure of the N-terminal-deleted INX-6 in a nanodisc [micrographs - single frame]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9973.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9973.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.232 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
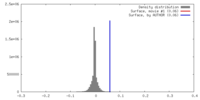
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : octameric complex of innexin-6
| 全体 | 名称: octameric complex of innexin-6 |
|---|---|
| 要素 |
|
-超分子 #1: octameric complex of innexin-6
| 超分子 | 名称: octameric complex of innexin-6 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Innexin-6
| 分子 | 名称: Innexin-6 / タイプ: protein_or_peptide / ID: 1 / コピー数: 8 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 45.173766 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MASQVGAINS VNALISRVFV QPKGDLADRL NSRVTVVILA VSSALLLSSH FIGDPITCWT PAQFNAQWVN FVNQYCFVHG TYFVPLDQQ LAFEEEERTK VSIQYYQWVP YVFALQAFLF YIPRFIWKAM IAYSGYDLAA AVKYVDRFWS ENRDKDDKFK T RLAAFEGR ...文字列: MASQVGAINS VNALISRVFV QPKGDLADRL NSRVTVVILA VSSALLLSSH FIGDPITCWT PAQFNAQWVN FVNQYCFVHG TYFVPLDQQ LAFEEEERTK VSIQYYQWVP YVFALQAFLF YIPRFIWKAM IAYSGYDLAA AVKYVDRFWS ENRDKDDKFK T RLAAFEGR PSVYIWDGIR LARKKRSRNM ALFYTLSTVW QAVNAWIQFY ILTQLLDSSI YTLWGPSILG DLLQGNDWQT TG HFPRIVH CDFNRRRPAS VQLDTVLCVL TLNIYYEKLF IFLWFWLVFV AVVSTVNCFK WIYYLCNKTK AQKTIKNYLS TAP IKSTIS DDQFFSALGE DGLFIMDQMA LNLGDIPASY LTISMRNICQ DFIESEDYID EERTPFVKSI KHT UniProtKB: Innexin-6 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 3000SFF |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 35.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)