+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9662 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 19A ZPC cryo-EM map of Eh V-ATPase-Fab | |||||||||
 マップデータ マップデータ | 19A ZPC cryo-EM map of Eh V-ATPase-Fab | |||||||||
 試料 試料 |
| |||||||||
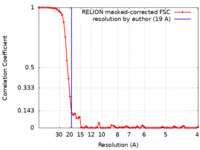
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 19.0 Å | |||||||||
 データ登録者 データ登録者 | Tsunoda J / Song C / Imai FL / Murata T / Ueno H / Iino R / Takagi J / Murata K | |||||||||
 引用 引用 |  ジャーナル: Sci Rep / 年: 2018 ジャーナル: Sci Rep / 年: 2018タイトル: Off-axis rotor in Enterococcus hirae V-ATPase visualized by Zernike phase plate single-particle cryo-electron microscopy. 著者: Jun Tsunoda / Chihong Song / Fabiana Lica Imai / Junichi Takagi / Hiroshi Ueno / Takeshi Murata / Ryota Iino / Kazuyoshi Murata /  要旨: EhV-ATPase is an ATP-driven Na pump in the eubacteria Enterococcus hirae (Eh). Here, we present the first entire structure of detergent-solubilized EhV-ATPase by single-particle cryo-electron ...EhV-ATPase is an ATP-driven Na pump in the eubacteria Enterococcus hirae (Eh). Here, we present the first entire structure of detergent-solubilized EhV-ATPase by single-particle cryo-electron microscopy (cryo-EM) using Zernike phase plate. The cryo-EM map dominantly showed one of three catalytic conformations in this rotary enzyme. To further stabilize the originally heterogeneous structure caused by the ATP hydrolysis states of the V-ATPases, a peptide epitope tag system was adopted, in which the inserted peptide epitope sequence interfered with rotation of the central rotor by binding the Fab. As a result, the map unexpectedly showed another catalytic conformation of EhV-ATPase. Interestingly, these two conformations identified with and without Fab conversely coincided with those of the minor state 2 and the major state 1 of Thermus thermophilus V/A-ATPase, respectively. The most prominent feature in EhV-ATPase was the off-axis rotor, where the cytoplasmic V domain was connected to the transmembrane V domain through the off-axis central rotor. Furthermore, compared to the structure of ATP synthases, the larger size of the interface between the transmembrane a-subunit and c-ring of EhV-ATPase would be more advantageous for active ion pumping. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9662.map.gz emd_9662.map.gz | 27.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9662-v30.xml emd-9662-v30.xml emd-9662.xml emd-9662.xml | 12.2 KB 12.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_9662_fsc.xml emd_9662_fsc.xml | 6.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_9662.png emd_9662.png | 46.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9662 http://ftp.pdbj.org/pub/emdb/structures/EMD-9662 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9662 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9662 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_9662_validation.pdf.gz emd_9662_validation.pdf.gz | 78.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_9662_full_validation.pdf.gz emd_9662_full_validation.pdf.gz | 77.5 KB | 表示 | |
| XML形式データ |  emd_9662_validation.xml.gz emd_9662_validation.xml.gz | 494 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9662 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9662 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9662 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9662 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9662.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9662.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 19A ZPC cryo-EM map of Eh V-ATPase-Fab | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.992 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Enterococcus hirae V-ATPse
| 全体 | 名称: Enterococcus hirae V-ATPse |
|---|---|
| 要素 |
|
-超分子 #1: Enterococcus hirae V-ATPse
| 超分子 | 名称: Enterococcus hirae V-ATPse / タイプ: complex / ID: 1 / 親要素: 0 |
|---|---|
| 組換発現 | 生物種:  |
| 分子量 | 実験値: 800 kDa/nm |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 糖包埋 | 材質: ice |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: MOLYBDENUM / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 2200FS |
|---|---|
| 温度 | 最低: 76.0 K / 最高: 76.0 K |
| 特殊光学系 | 位相板: ZERNIKE PHASE PLATE エネルギーフィルター - 名称: In-column Omega Filter エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: DIRECT ELECTRON DE-20 (5k x 3k) 検出モード: INTEGRATING / デジタル化 - サイズ - 横: 5120 pixel / デジタル化 - サイズ - 縦: 3840 pixel / デジタル化 - サンプリング間隔: 6.4 µm / デジタル化 - 画像ごとのフレーム数: 3-75 / 撮影したグリッド数: 5 / 実像数: 1302 / 平均露光時間: 3.0 sec. / 平均電子線量: 20.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 40.0 µm / 最大 デフォーカス(補正後): 0.5 µm / 最小 デフォーカス(補正後): 0.25 µm / 倍率(補正後): 32129 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 4.2 mm / 最大 デフォーカス(公称値): 0.5 µm / 最小 デフォーカス(公称値): 0.25 µm / 倍率(公称値): 30000 |
| 試料ステージ | 試料ホルダーモデル: GATAN 914 HIGH TILT LIQUID NITROGEN CRYO TRANSFER TOMOGRAPHY HOLDER ホルダー冷却材: NITROGEN |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)