+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of AaaA, a Pseudomonas Aeruginosa autotransporter | |||||||||
 マップデータ マップデータ | Cryo-EM map from the local refinement. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Arginine aminopeptidase / Autotransporter / Pseudomonas Aeruginosa / Virulence factor / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報autotransporter activity / outer membrane / metalloexopeptidase activity / aminopeptidase activity / cell motility / proteolysis 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.87 Å | |||||||||
 データ登録者 データ登録者 | Arachchige EJ / Rahman MS / Singendonk K / Kim KH | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2025 ジャーナル: J Mol Biol / 年: 2025タイトル: Structural and Functional Characterization of Pseudomonas aeruginosa Virulence Factor AaaA, an Autotransporter with Arginine-Specific Aminopeptidase Activity. 著者: Erandi Jayawardana Arachchige / Md Shafiqur Rahman / Katharina S Singendonk / Kelly H Kim /  要旨: AaaA is a virulence-associated outer membrane protein found in the Gram-negative pathogen Pseudomonas aeruginosa. Classified as both an autotransporter and a member of the M28 family of ...AaaA is a virulence-associated outer membrane protein found in the Gram-negative pathogen Pseudomonas aeruginosa. Classified as both an autotransporter and a member of the M28 family of aminopeptidases, AaaA has been shown to cleave N-terminal arginine residues from host-derived peptides. This activity has been demonstrated to enhance bacterial survival and suppress host immune responses by increasing local arginine availability. Here, we report the first successful purification and combined structural and biochemical characterization of full-length AaaA. We resolved its cryo-EM structure at 3.87 Å resolution, revealing the canonical three-domain architecture of autotransporters: a signal peptide, a passenger domain, and a translocator domain. Notably, the passenger domain adopts a compact globular fold characteristic of M28 aminopeptidases, which is less common than the extended or β-helical structures observed in the majority of autotransporters structurally characterized to date. The structure reveals a zinc-coordinated catalytic site and a negatively charged substrate binding pocket, consistent with specificity for positively charged N-terminal arginine residues. Mutagenesis of active site residues confirmed the molecular basis for arginine recognition. Functional assays demonstrated that AaaA exhibits zinc-dependent aminopeptidase activity across a broad pH (6-10) and temperature (20-60 °C) range. Together, these findings provide fundamental insights into the structure and function of AaaA and establish a framework for future efforts to develop targeted inhibitors that may attenuate P. aeruginosa virulence. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_70744.map.gz emd_70744.map.gz | 85.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-70744-v30.xml emd-70744-v30.xml emd-70744.xml emd-70744.xml | 22.8 KB 22.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_70744.png emd_70744.png | 42.9 KB | ||
| Filedesc metadata |  emd-70744.cif.gz emd-70744.cif.gz | 7.5 KB | ||
| その他 |  emd_70744_half_map_1.map.gz emd_70744_half_map_1.map.gz emd_70744_half_map_2.map.gz emd_70744_half_map_2.map.gz | 84.5 MB 84.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-70744 http://ftp.pdbj.org/pub/emdb/structures/EMD-70744 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-70744 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-70744 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_70744_validation.pdf.gz emd_70744_validation.pdf.gz | 843.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_70744_full_validation.pdf.gz emd_70744_full_validation.pdf.gz | 842.6 KB | 表示 | |
| XML形式データ |  emd_70744_validation.xml.gz emd_70744_validation.xml.gz | 13 KB | 表示 | |
| CIF形式データ |  emd_70744_validation.cif.gz emd_70744_validation.cif.gz | 15.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-70744 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-70744 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-70744 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-70744 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9oqaMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_70744.map.gz / 形式: CCP4 / 大きさ: 91.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_70744.map.gz / 形式: CCP4 / 大きさ: 91.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map from the local refinement. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.886 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Cryo-EM halfmap2 of the local refinement.
| ファイル | emd_70744_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM halfmap2 of the local refinement. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Cryo-EM halfmap1 of the local refinement.
| ファイル | emd_70744_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM halfmap1 of the local refinement. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : AaaA complex with Arginine
| 全体 | 名称: AaaA complex with Arginine |
|---|---|
| 要素 |
|
-超分子 #1: AaaA complex with Arginine
| 超分子 | 名称: AaaA complex with Arginine / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: The full length AaaA contain two domains: a globular passenger domain and a beta barrel translocator domain. |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 70.36 KDa |
-分子 #1: Autotransporter domain-containing protein
| 分子 | 名称: Autotransporter domain-containing protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 72.329414 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: ASAWSHPQFE KGGGSGGGSG GSAWSHPQFE KENLYFQGYQ YGEYAGETLE RLITDYPGRY RGTASFAGAS KLMQSRLGFG YQTSRQDFT WAGNRSSQNV IASAPGSSGK FLVLGAHYDT YYGRPTLQGL DDNASGAAVL TEIARNLGGI ALENGLEVVG F GAEEEGLR ...文字列: ASAWSHPQFE KGGGSGGGSG GSAWSHPQFE KENLYFQGYQ YGEYAGETLE RLITDYPGRY RGTASFAGAS KLMQSRLGFG YQTSRQDFT WAGNRSSQNV IASAPGSSGK FLVLGAHYDT YYGRPTLQGL DDNASGAAVL TEIARNLGGI ALENGLEVVG F GAEEEGLR GSRAYVESLD ASQRANLLGM INLDSLVTGD KMYAHAGSNS VSNPALGAYR EQILRIAREL DIPLFTNPGL NA EYPAGTG CCSDGESFNG MDIPVLFIEA TNWELGDLDG YEQTDNPAIP GGSTWHDPAE DNKEVLTNAL GQERIEQRMR DFS RLLTRL VLEQTNADLL ASTASGGALA RQMEDQLQRQ HQALTRLHDR RWLTLLGSNR PVGSFDGEVG AEGEVSPDSG FDMP GNPES RRAGVHLLGD YRYSEALTLG GSLAFQRSRD KLDHGGRIEG DTWQLGLFGL YNDGGPEWLA GELNLGHTRY DSKRS VYLQ AAGGPVLLDQ RLSGDTSAWS WGARLEGGYD FSFGELRSGP LAGLDYMHYR IDDFREDEAL RTALGYEKQD YDSLEA SLG WRLRGELALG ARMRLQPYAS LRWVRELADG RLDDMDLTSR GDGRVRVADM GGVDKDFGRA QLGAQLAITE QLGVFAE AN SRFAHSEGNQ AGYSLGVNWQ F UniProtKB: Autotransporter domain-containing protein |
-分子 #2: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 2 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #3: ARGININE
| 分子 | 名称: ARGININE / タイプ: ligand / ID: 3 / コピー数: 1 / 式: ARG |
|---|---|
| 分子量 | 理論値: 175.209 Da |
| Chemical component information | 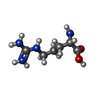 ChemComp-ARG: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 7.2 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: During solubilization of protein from membrane, 1% DDM was used. Subsequent purification buffers contain 0.05% DDM. | ||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 1200 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 0.034 kPa | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV 詳細: During vitrification 3 ul of sample placed on a grid and then vitrified with 10s hold and 4s blot time.. | ||||||||||||
| 詳細 | The protein sample was concentrated from the single peak fractions of size exclusion chromatography. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 温度 | 最低: 77.0 K / 最高: 100.0 K |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 7084 / 平均電子線量: 44.71 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.6 µm / 最小 デフォーカス(公称値): 0.4 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | Chain - Residue range: 23-647 / Chain - Source name: AlphaFold / Chain - Initial model type: in silico model |
|---|---|
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-9oqa: |
 ムービー
ムービー コントローラー
コントローラー





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































