+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6379 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Electron Microscopy of Bg505 in complex with 9H3L antibody | |||||||||
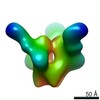
 マップデータ マップデータ | Bg505 SOSIP in complex with 9H3L | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Simian-Human immunodeficiency virus (ウイルス) / Simian-Human immunodeficiency virus (ウイルス) /  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 21.0 Å | |||||||||
 データ登録者 データ登録者 | Garces F / de Val N / Ward AB / Wilson IA | |||||||||
 引用 引用 |  ジャーナル: Immunity / 年: 2015 ジャーナル: Immunity / 年: 2015タイトル: Affinity Maturation of a Potent Family of HIV Antibodies Is Primarily Focused on Accommodating or Avoiding Glycans. 著者: Fernando Garces / Jeong Hyun Lee / Natalia de Val / Alba Torrents de la Pena / Leopold Kong / Cristina Puchades / Yuanzi Hua / Robyn L Stanfield / Dennis R Burton / John P Moore / Rogier W ...著者: Fernando Garces / Jeong Hyun Lee / Natalia de Val / Alba Torrents de la Pena / Leopold Kong / Cristina Puchades / Yuanzi Hua / Robyn L Stanfield / Dennis R Burton / John P Moore / Rogier W Sanders / Andrew B Ward / Ian A Wilson /   要旨: The high-mannose patch on the HIV-1 envelope (Env) glycoprotein is the epicenter for binding of the potent broadly neutralizing PGT121 family of antibodies, but strategies for generating such ...The high-mannose patch on the HIV-1 envelope (Env) glycoprotein is the epicenter for binding of the potent broadly neutralizing PGT121 family of antibodies, but strategies for generating such antibodies by vaccination have not been defined. We generated structures of inferred antibody intermediates by X-ray crystallography and electron microscopy to elucidate the molecular events that occurred during evolution of this family. Binding analyses revealed that affinity maturation was primarily focused on avoiding, accommodating, or binding the N137 glycan. The overall antibody approach angle to Env was defined very early in the maturation process, yet some variation evolved in the PGT121 family branches that led to differences in glycan specificities in their respective epitopes. Furthermore, we determined a crystal structure of the recombinant BG505 SOSIP.664 HIV-1 trimer with a PGT121 family member at 3.0 Å that, in concert with these antibody intermediate structures, provides insights to advance design of HIV vaccine candidates. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6379.map.gz emd_6379.map.gz | 1.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6379-v30.xml emd-6379-v30.xml emd-6379.xml emd-6379.xml | 10.6 KB 10.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  400_6379.gif 400_6379.gif 80_6379.gif 80_6379.gif | 15.7 KB 2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6379 http://ftp.pdbj.org/pub/emdb/structures/EMD-6379 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6379 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6379 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6379_validation.pdf.gz emd_6379_validation.pdf.gz | 77.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6379_full_validation.pdf.gz emd_6379_full_validation.pdf.gz | 77 KB | 表示 | |
| XML形式データ |  emd_6379_validation.xml.gz emd_6379_validation.xml.gz | 494 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6379 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6379 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6379 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6379 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6379.map.gz / 形式: CCP4 / 大きさ: 1.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6379.map.gz / 形式: CCP4 / 大きさ: 1.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Bg505 SOSIP in complex with 9H3L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Bg505 SOSIP in complex with 9H3L
| 全体 | 名称: Bg505 SOSIP in complex with 9H3L |
|---|---|
| 要素 |
|
-超分子 #1000: Bg505 SOSIP in complex with 9H3L
| 超分子 | 名称: Bg505 SOSIP in complex with 9H3L / タイプ: sample / ID: 1000 / 集合状態: one trimer of Bg505 bound to three Fabs / Number unique components: 2 |
|---|---|
| 分子量 | 実験値: 570 KDa / 理論値: 570 KDa / 手法: Size exclusion chromatography |
-分子 #1: Bg505 SOSIP
| 分子 | 名称: Bg505 SOSIP / タイプ: protein_or_peptide / ID: 1 / 集合状態: trimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Simian-Human immunodeficiency virus (ウイルス) Simian-Human immunodeficiency virus (ウイルス)別称: HIV |
| 分子量 | 実験値: 570 KDa / 理論値: 570 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) / 組換細胞: HEK293F Homo sapiens (ヒト) / 組換細胞: HEK293F |
-分子 #2: 9H3L antibody
| 分子 | 名称: 9H3L antibody / タイプ: protein_or_peptide / ID: 2 / コピー数: 3 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: human Homo sapiens (ヒト) / 別称: human |
| 組換発現 | 生物種:  Homo sapiens (ヒト) / 組換細胞: HEK293F Homo sapiens (ヒト) / 組換細胞: HEK293F |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.03 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 詳細: 50 mM Tris-HCl, 150 mM NaCl |
| 染色 | タイプ: NEGATIVE 詳細: Grids were stained for 30 seconds using 2% uranyl formate. |
| グリッド | 詳細: 400 Cu mesh grids were negatively glow discharged for 30 seconds at 20 mA. |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI SPIRIT |
|---|---|
| 日付 | 2015年5月8日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F416 (4k x 4k) 実像数: 126 / 平均電子線量: 30.43 e/Å2 |
| Tilt angle min | 0 |
| 電子線 | 加速電圧: 120 kV / 電子線源: LAB6 |
| 電子光学系 | 倍率(補正後): 52000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 46000 |
| 試料ステージ | 試料ホルダーモデル: OTHER / Tilt angle max: 50 |
| 実験機器 |  モデル: Tecnai Spirit / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | The particles were selected and processed using Appion. |
|---|---|
| 最終 再構成 | アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 21.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: sparx, EMAN2 / 使用した粒子像数: 16946 |
| 最終 2次元分類 | クラス数: 147 |
-原子モデル構築 1
| 初期モデル | PDB ID: |
|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera










 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






















