+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | cryo-EM structure of a nanobody bound heliorhodopsin | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | bacterial rhodopsin / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 | Heliorhodopsin / Heliorhodopsin / membrane / Heliorhodopsin 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |   | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.23 Å | |||||||||
 データ登録者 データ登録者 | He Y / Xia R | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Biochem Biophys Res Commun / 年: 2025 ジャーナル: Biochem Biophys Res Commun / 年: 2025タイトル: Cryo-EM structure of a nanobody-bound heliorhodopsin. 著者: Ruixue Xia / Mingxia Sun / Yang Lu / Na Wang / Anqi Zhang / Changyou Guo / Zhenmei Xu / Xuehui Cai / Yuanzheng He /  要旨: Heliorhodopsins (HeRs) represent a distinct class of microbial rhodopsins (MRs) with an inverted membrane topology compared to other MRs. Previous structural studies have shown that HeRs lack a ...Heliorhodopsins (HeRs) represent a distinct class of microbial rhodopsins (MRs) with an inverted membrane topology compared to other MRs. Previous structural studies have shown that HeRs lack a proton acceptor residue, and protons are never released from the protein. In this study, we present the cryo-electron microscopy (cryo-EM) structure of HeR bound to a nanobody. The structure reveals an acetate-like molecule in the Schiff base cavity (SBC) on the intracellular side of HeR under neutral condition. Structural comparisons and analyses suggest that the acetate molecule may function as a proton acceptor for the protonated retinal Schiff base (RSB) and act as a mediator for the intramolecular signaling transduction in HeR during light stimulation. These structural insights shed new light on the mechanism and function of HeR. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_63157.map.gz emd_63157.map.gz | 33.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-63157-v30.xml emd-63157-v30.xml emd-63157.xml emd-63157.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_63157.png emd_63157.png | 92.7 KB | ||
| マスクデータ |  emd_63157_msk_1.map emd_63157_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-63157.cif.gz emd-63157.cif.gz | 5.7 KB | ||
| その他 |  emd_63157_half_map_1.map.gz emd_63157_half_map_1.map.gz emd_63157_half_map_2.map.gz emd_63157_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-63157 http://ftp.pdbj.org/pub/emdb/structures/EMD-63157 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-63157 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-63157 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_63157_validation.pdf.gz emd_63157_validation.pdf.gz | 856.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_63157_full_validation.pdf.gz emd_63157_full_validation.pdf.gz | 856.1 KB | 表示 | |
| XML形式データ |  emd_63157_validation.xml.gz emd_63157_validation.xml.gz | 12.4 KB | 表示 | |
| CIF形式データ |  emd_63157_validation.cif.gz emd_63157_validation.cif.gz | 14.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-63157 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-63157 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-63157 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-63157 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9ljjMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_63157.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_63157.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_63157_msk_1.map emd_63157_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_63157_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_63157_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : dimer complex
| 全体 | 名称: dimer complex |
|---|---|
| 要素 |
|
-超分子 #1: dimer complex
| 超分子 | 名称: dimer complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Heliorhodopsin
| 分子 | 名称: Heliorhodopsin / タイプ: protein_or_peptide / ID: 1 詳細: Sequence reference for source organism Escherichia coli is not available in UniProt at the time of biocuration. Current sequence reference is from UniProt id A0A2R4S913. コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 28.026078 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAKPTVKEIK SLQNFNRIAG VFHLLQMLAV LALANDFALP MTGTYLNGPP GTTFSAPVVI LETPVGLAVA LFLGLSALFH FIVSSGNFF KRYSASLMKN QNIFRWVEYS LSSSVMIVLI AQICGIADIV ALLAIFGVNA SMILFGWLQE KYTQPKDGDL L PFWFGCIA ...文字列: MAKPTVKEIK SLQNFNRIAG VFHLLQMLAV LALANDFALP MTGTYLNGPP GTTFSAPVVI LETPVGLAVA LFLGLSALFH FIVSSGNFF KRYSASLMKN QNIFRWVEYS LSSSVMIVLI AQICGIADIV ALLAIFGVNA SMILFGWLQE KYTQPKDGDL L PFWFGCIA GIVPWIGLLI YVIAPGSTSD VAVPGFVYGI IISLFLFFNS FALVQYLQYK GKGKWSNYLR GERAYIVLSL VA KSALAWQ IFSGTLIPA UniProtKB: Heliorhodopsin |
-分子 #2: nanobody B4
| 分子 | 名称: nanobody B4 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 13.289878 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MVQLVESGGG LVQAGGSLRL SCAASGMAFS ISRMEWHRQA PGNERELVAR ITGGGRTTYG DSVKGRFTIS RDNAKSMVYL QMNSLKPED TAVYYCNTGY FWGQGTQVTV SSAAALEHHH HHH |
-分子 #3: RETINAL
| 分子 | 名称: RETINAL / タイプ: ligand / ID: 3 / コピー数: 2 / 式: RET |
|---|---|
| 分子量 | 理論値: 284.436 Da |
| Chemical component information | 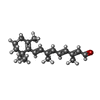 ChemComp-RET: |
-分子 #4: ACETATE ION
| 分子 | 名称: ACETATE ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: ACT |
|---|---|
| 分子量 | 理論値: 59.044 Da |
| Chemical component information |  ChemComp-ACT: |
-分子 #5: 1,2-DILAUROYL-SN-GLYCERO-3-PHOSPHATE
| 分子 | 名称: 1,2-DILAUROYL-SN-GLYCERO-3-PHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 1 / 式: PX2 |
|---|---|
| 分子量 | 理論値: 535.671 Da |
| Chemical component information |  ChemComp-PX2: |
-分子 #6: PALMITIC ACID
| 分子 | 名称: PALMITIC ACID / タイプ: ligand / ID: 6 / コピー数: 3 / 式: PLM |
|---|---|
| 分子量 | 理論値: 256.424 Da |
| Chemical component information |  ChemComp-PLM: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F30 |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Tecnai F30 / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.23 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 239778 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)












































