[English] 日本語
 Yorodumi
Yorodumi- EMDB-60388: Human high-affinity choline transporter CHT1 bound to choline und... -
+ Open data
Open data
- Basic information
Basic information
| Entry |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Human high-affinity choline transporter CHT1 bound to choline under NaCl condition, with sodium and chloride ions coordinated. | |||||||||
 Map data Map data | ||||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | transporter / STRUCTURAL PROTEIN | |||||||||
| Function / homology |  Function and homology information Function and homology informationcholine:sodium symporter activity / Defective SLC5A7 causes distal hereditary motor neuronopathy 7A (HMN7A) / Defective SLC5A7 causes distal hereditary motor neuronopathy 7A (HMN7A) / acetylcholine biosynthetic process / : / choline transmembrane transporter activity / Acetylcholine Neurotransmitter Release Cycle / choline transport / neuromuscular synaptic transmission / choline binding ...choline:sodium symporter activity / Defective SLC5A7 causes distal hereditary motor neuronopathy 7A (HMN7A) / Defective SLC5A7 causes distal hereditary motor neuronopathy 7A (HMN7A) / acetylcholine biosynthetic process / : / choline transmembrane transporter activity / Acetylcholine Neurotransmitter Release Cycle / choline transport / neuromuscular synaptic transmission / choline binding / synaptic transmission, cholinergic / neurotransmitter transport / neuromuscular junction / transmembrane transport / synaptic vesicle membrane / presynaptic membrane / early endosome membrane / in utero embryonic development / perikaryon / axon / synapse / dendrite / membrane / plasma membrane Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 2.5 Å | |||||||||
 Authors Authors | Qiu Y / Gao Y / Zhao Y | |||||||||
| Funding support |  China, 1 items China, 1 items
| |||||||||
 Citation Citation |  Journal: Structure / Year: 2025 Journal: Structure / Year: 2025Title: Ion coupling and inhibitory mechanisms of the human presynaptic high-affinity choline transporter CHT1. Authors: Yunlong Qiu / Yiwei Gao / Qinru Bai / Yan Zhao /  Abstract: In cholinergic neurons, choline is the precursor of the excitatory neurotransmitter acetylcholine (ACh), which plays a fundamental role in the brain. The high-affinity choline transporter, CHT1, ...In cholinergic neurons, choline is the precursor of the excitatory neurotransmitter acetylcholine (ACh), which plays a fundamental role in the brain. The high-affinity choline transporter, CHT1, mediates the efficient recycling of choline to facilitate ACh synthesis in the presynapse. Here, we report high-resolution cryoelectron microscopic (cryo-EM) structures of CHT1 in complex with the inhibitors HC-3 and ML352, the substrate choline, and a substrate-free state. Our structures show distinct binding modes of the inhibitors with different chemical structures, revealing their inhibition mechanisms. Additionally, we observed a chloride ion that directly interacts with the substrate choline, thereby stabilizing its binding with CHT1. Two sodium ions, Na2 and Na3, were clearly identified, which we speculate might be involved in substrate binding and conformational transitions, respectively. Our structures provide molecular insights into the coupling mechanism of ion binding with substrate binding and conformational transitions, promoting our understanding of the ion-coupled substrate transport mechanism. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_60388.map.gz emd_60388.map.gz | 117.9 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-60388-v30.xml emd-60388-v30.xml emd-60388.xml emd-60388.xml | 19.6 KB 19.6 KB | Display Display |  EMDB header EMDB header |
| Images |  emd_60388.png emd_60388.png | 107.3 KB | ||
| Filedesc metadata |  emd-60388.cif.gz emd-60388.cif.gz | 6.7 KB | ||
| Others |  emd_60388_half_map_1.map.gz emd_60388_half_map_1.map.gz emd_60388_half_map_2.map.gz emd_60388_half_map_2.map.gz | 116 MB 116 MB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-60388 http://ftp.pdbj.org/pub/emdb/structures/EMD-60388 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-60388 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-60388 | HTTPS FTP |
-Related structure data
| Related structure data |  8zqqMC  8zqoC  8zqpC  8zqrC M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_60388.map.gz / Format: CCP4 / Size: 125 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_60388.map.gz / Format: CCP4 / Size: 125 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 0.85 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
-Half map: #1
| File | emd_60388_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: #2
| File | emd_60388_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
- Sample components
Sample components
-Entire : Human high-affinity choline transporter CHT1 bound to choline und...
| Entire | Name: Human high-affinity choline transporter CHT1 bound to choline under NaCl condition, with sodium and chloride ions coordinated. |
|---|---|
| Components |
|
-Supramolecule #1: Human high-affinity choline transporter CHT1 bound to choline und...
| Supramolecule | Name: Human high-affinity choline transporter CHT1 bound to choline under NaCl condition, with sodium and chloride ions coordinated. type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1 |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
-Macromolecule #1: High affinity choline transporter 1
| Macromolecule | Name: High affinity choline transporter 1 / type: protein_or_peptide / ID: 1 / Number of copies: 1 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 63.239145 KDa |
| Recombinant expression | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Sequence | String: MAFHVEGLIA IIVFYLLILL VGIWAAWRTK NSGSAEERSE AIIVGGRDIG LLVGGFTMTA TWVGGGYING TAEAVYVPGY GLAWAQAPI GYSLSLILGG LFFAKPMRSK GYVTMLDPFQ QIYGKRMGGL LFIPALMGEM FWAAAIFSAL GATISVIIDV D MHISVIIS ...String: MAFHVEGLIA IIVFYLLILL VGIWAAWRTK NSGSAEERSE AIIVGGRDIG LLVGGFTMTA TWVGGGYING TAEAVYVPGY GLAWAQAPI GYSLSLILGG LFFAKPMRSK GYVTMLDPFQ QIYGKRMGGL LFIPALMGEM FWAAAIFSAL GATISVIIDV D MHISVIIS ALIATLYTLV GGLYSVAYTD VVQLFCIFVG LWISVPFALS HPAVADIGFT AVHAKYQKPW LGTVDSSEVY SW LDSFLLL MLGGIPWQAY FQRVLSSSSA TYAQVLSFLA AFGCLVMAIP AILIGAIGAS TDWNQTAYGL PDPKTTEEAD MIL PIVLQY LCPVYISFFG LGAVSAAVMS SADSSILSAS SMFARNIYQL SFRQNASDKE IVWVMRITVF VFGASATAMA LLTK TVYGL WYLSSDLVYI VIFPQLLCVL FVKGTNTYGA VAGYVSGLFL RITGGEPYLY LQPLIFYPGY YPDDNGIYNQ KFPFK TLAM VTSFLTNICI SYLAKYLFES GTLPPKLDVF DAVVARHSEE NMDKTILVKN ENIKLDELAL VKPRQSMTLS STFTNK EAF LDVDSSPEGS GTEDNLQ UniProtKB: High affinity choline transporter 1 |
-Macromolecule #3: CHOLINE ION
| Macromolecule | Name: CHOLINE ION / type: ligand / ID: 3 / Number of copies: 1 / Formula: CHT |
|---|---|
| Molecular weight | Theoretical: 104.171 Da |
| Chemical component information | 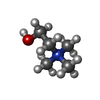 ChemComp-CHT: |
-Macromolecule #4: SODIUM ION
| Macromolecule | Name: SODIUM ION / type: ligand / ID: 4 / Number of copies: 1 |
|---|---|
| Molecular weight | Theoretical: 22.99 Da |
-Macromolecule #5: CHLORIDE ION
| Macromolecule | Name: CHLORIDE ION / type: ligand / ID: 5 / Number of copies: 1 / Formula: CL |
|---|---|
| Molecular weight | Theoretical: 35.453 Da |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Concentration | 10 mg/mL |
|---|---|
| Buffer | pH: 7.5 |
| Grid | Model: Quantifoil R1.2/1.3 / Material: COPPER / Mesh: 300 / Pretreatment - Type: GLOW DISCHARGE / Pretreatment - Time: 60 sec. |
| Vitrification | Cryogen name: ETHANE / Chamber humidity: 100 % / Chamber temperature: 277 K / Instrument: FEI VITROBOT MARK IV |
| Details | This sample was obtained from the monodispersed peak fractions of the size-exclusion chromatography. |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Image recording | Film or detector model: GATAN K3 (6k x 4k) / Average electron dose: 60.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm / Nominal defocus max: 2.2 µm / Nominal defocus min: 1.2 µm |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
+ Image processing
Image processing
-Atomic model buiding 1
| Refinement | Protocol: AB INITIO MODEL |
|---|---|
| Output model |  PDB-8zqq: |
 Movie
Movie Controller
Controller







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































