+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-5772 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | A Two-Pronged Structural Analysis of Retroviral Maturation Indicates that Core Formation Proceeds by a Disassembly-Reassembly Pathway Rather than a Displacive Transition | |||||||||
 マップデータ マップデータ | T=1 icosahedral assembly of Rous sarcoma virus CA-SP protein | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Cryo-EM / Rous Sarcoma Virus Structure / in vitro assembled capsids / spacer peptide | |||||||||
| 生物種 |  Rous sarcoma virus (ラウス肉腫ウイルス) Rous sarcoma virus (ラウス肉腫ウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 8.5 Å | |||||||||
 データ登録者 データ登録者 | Keller PW / Huang RK / England M / Waki K / Cheng N / Heymann JB / Craven RC / Freed EO / Steven AC | |||||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2013 ジャーナル: J Virol / 年: 2013タイトル: A two-pronged structural analysis of retroviral maturation indicates that core formation proceeds by a disassembly-reassembly pathway rather than a displacive transition. 著者: Paul W Keller / Rick K Huang / Matthew R England / Kayoko Waki / Naiqian Cheng / J Bernard Heymann / Rebecca C Craven / Eric O Freed / Alasdair C Steven /  要旨: Retrovirus maturation involves sequential cleavages of the Gag polyprotein, initially arrayed in a spherical shell, leading to formation of capsids with polyhedral or conical morphology. Evidence ...Retrovirus maturation involves sequential cleavages of the Gag polyprotein, initially arrayed in a spherical shell, leading to formation of capsids with polyhedral or conical morphology. Evidence suggests that capsids assemble de novo inside maturing virions from dissociated capsid (CA) protein, but the possibility persists of a displacive pathway in which the CA shell remains assembled but is remodeled. Inhibition of the final cleavage between CA and spacer peptide SP1/SP blocks the production of mature capsids. We investigated whether retention of SP might render CA assembly incompetent by testing the ability of Rous sarcoma virus (RSV) CA-SP to assemble in vitro into icosahedral capsids. Capsids were indeed assembled and were indistinguishable from those formed by CA alone, indicating that SP was disordered. We also used cryo-electron tomography to characterize HIV-1 particles produced in the presence of maturation inhibitor PF-46396 or with the cleavage-blocking CA5 mutation. Inhibitor-treated virions have a shell that resembles the CA layer of the immature Gag shell but is less complete. Some CA protein is generated but usually not enough for a mature core to assemble. We propose that inhibitors like PF-46396 bind to the Gag lattice where they deny the protease access to the CA-SP1 cleavage site and prevent the release of CA. CA5 particles, which exhibit no cleavage at the CA-SP1 site, have spheroidal shells with relatively thin walls. It appears that this lattice progresses displacively toward a mature-like state but produces neither conical cores nor infectious virions. These observations support the disassembly-reassembly pathway for core formation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_5772.map.gz emd_5772.map.gz | 55.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-5772-v30.xml emd-5772-v30.xml emd-5772.xml emd-5772.xml | 12.3 KB 12.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_5772_fsc.xml emd_5772_fsc.xml | 3.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_5772.jpg emd_5772.jpg | 58.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-5772 http://ftp.pdbj.org/pub/emdb/structures/EMD-5772 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5772 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5772 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_5772_validation.pdf.gz emd_5772_validation.pdf.gz | 78.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_5772_full_validation.pdf.gz emd_5772_full_validation.pdf.gz | 77.5 KB | 表示 | |
| XML形式データ |  emd_5772_validation.xml.gz emd_5772_validation.xml.gz | 494 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5772 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5772 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5772 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5772 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_5772.map.gz / 形式: CCP4 / 大きさ: 58.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_5772.map.gz / 形式: CCP4 / 大きさ: 58.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | T=1 icosahedral assembly of Rous sarcoma virus CA-SP protein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.27 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
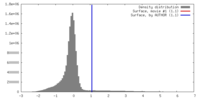
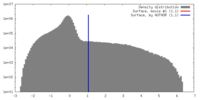
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : T=1 icosahedral assembly of Rous sarcoma virus capsid proteins wi...
| 全体 | 名称: T=1 icosahedral assembly of Rous sarcoma virus capsid proteins with spacer peptide |
|---|---|
| 要素 |
|
-超分子 #1000: T=1 icosahedral assembly of Rous sarcoma virus capsid proteins wi...
| 超分子 | 名称: T=1 icosahedral assembly of Rous sarcoma virus capsid proteins with spacer peptide タイプ: sample / ID: 1000 集合状態: T=1 icosahedral shell with 60 subunits forming 12 pentamers Number unique components: 1 |
|---|---|
| 分子量 | 理論値: 1.51 MDa |
-超分子 #1: Rous sarcoma virus
| 超分子 | 名称: Rous sarcoma virus / タイプ: virus / ID: 1 / 詳細: icosahedral assembly of CA-SP protein / NCBI-ID: 11886 / 生物種: Rous sarcoma virus / ウイルスタイプ: VIRUS-LIKE PARTICLE / ウイルス・単離状態: SPECIES / ウイルス・エンベロープ: No / ウイルス・中空状態: Yes |
|---|---|
| 宿主 | 生物種:  |
| Host system | 生物種:  |
| 分子量 | 理論値: 1.51 MDa |
| ウイルス殻 | Shell ID: 1 / T番号(三角分割数): 1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 10 mM Tris-HCl, 75 mM sodium chloride, 0.05 mM EDTA, 0.5 M sodium phosphate |
| グリッド | 詳細: Holey carbon film on R2/2 400 mesh copper grid |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 93.15 K / 装置: LEICA KF80 / 詳細: Vitrification carried out in nitrogen atmosphere. 手法: 4.0 microliter sample dropped onto grid, blotted on one side for 2 second, then plunged. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM200FEG |
|---|---|
| 温度 | 平均: 93.15 K |
| 日付 | 2011年9月24日 |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM デジタル化 - スキャナー: NIKON SUPER COOLSCAN 9000 デジタル化 - サンプリング間隔: 6.35 µm / 実像数: 17 / 平均電子線量: 15 e/Å2 / ビット/ピクセル: 16 |
| 電子線 | 加速電圧: 120 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.7 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| ソフトウェア | 名称:  Chimera Chimera |
| 詳細 | RSV CA NTD and CTD structures were rigid-body fitted into the T=1 density map using Chimera fit to map tools. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
-原子モデル構築 2
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| ソフトウェア | 名称:  Chimera Chimera |
| 詳細 | RSV CA NTD and CTD structures were rigid-body fitted into the T=1 density map using Chimera fit to map tools. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)