+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of holo-GmNifEN | ||||||||||||
 マップデータ マップデータ | CryoEM structure of holo-GmNifEN sharped with EMready | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | NITROGENASE COFACTOR MATURATION / PROTEIN BINDING / Metalloenzyme / Iron-Sulfur Cluster / METAL BINDING PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||||||||
| 生物種 |  Geobacter metallireducens (バクテリア) Geobacter metallireducens (バクテリア) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.86 Å | ||||||||||||
 データ登録者 データ登録者 | Paya Tormo L / Nguyen TQ / Fyfe C / Basbous H / Dobrzynska K / Echavarri-Erasun C / Martin L / Caserta G / Legrand P / Thorn A ...Paya Tormo L / Nguyen TQ / Fyfe C / Basbous H / Dobrzynska K / Echavarri-Erasun C / Martin L / Caserta G / Legrand P / Thorn A / Amara P / Schoehn G / Cherrier MV / Rubio LM / Nicolet Y | ||||||||||||
| 資金援助 |  フランス, 3件 フランス, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Chem Biol / 年: 2025 ジャーナル: Nat Chem Biol / 年: 2025タイトル: Dynamics driving the precursor in NifEN scaffold during nitrogenase FeMo-cofactor assembly. 著者: Lucía Payá Tormo / Tu-Quynh Nguyen / Cameron Fyfe / Hind Basbous / Katarzyna Dobrzyńska / Carlos Echavarri-Erasun / Lydie Martin / Giorgio Caserta / Pierre Legrand / Andrea Thorn / ...著者: Lucía Payá Tormo / Tu-Quynh Nguyen / Cameron Fyfe / Hind Basbous / Katarzyna Dobrzyńska / Carlos Echavarri-Erasun / Lydie Martin / Giorgio Caserta / Pierre Legrand / Andrea Thorn / Patricia Amara / Guy Schoehn / Mickaël V Cherrier / Luis M Rubio / Yvain Nicolet /    要旨: Nitrogenase catalyzes atmospheric nitrogen fixation, a critical biological process that depends on an intricate organometallic cofactor assembled by a dedicated multiprotein system. Here we uncover ...Nitrogenase catalyzes atmospheric nitrogen fixation, a critical biological process that depends on an intricate organometallic cofactor assembled by a dedicated multiprotein system. Here we uncover the structural basis for the function of NifEN, the scaffold protein that mediates the final stages of cofactor biosynthesis before its incorporation into nitrogenase. High-resolution structural analyses reveal that the cofactor precursor initially binds at a surface docking site before being transferred into a specialized cavity for further maturation. This process involves dynamic structural rearrangements, including coordinated domain motions and partial unfolding, enabling the scaffold to alternate between open and closed states. Additionally, a rear channel extends to the precursor-binding cavity, likely facilitating the entry of the modifying components molybdenum and homocitrate. These findings illuminate the dynamic mechanisms underlying FeMo-cofactor assembly and underscore the functional divergence between NifEN, the biosynthetic scaffold, and NifDK, the catalytic component of nitrogenase. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_52557.map.gz emd_52557.map.gz | 47.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-52557-v30.xml emd-52557-v30.xml emd-52557.xml emd-52557.xml | 25.9 KB 25.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_52557_fsc.xml emd_52557_fsc.xml | 8.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_52557.png emd_52557.png | 36.6 KB | ||
| Filedesc metadata |  emd-52557.cif.gz emd-52557.cif.gz | 7.6 KB | ||
| その他 |  emd_52557_additional_1.map.gz emd_52557_additional_1.map.gz emd_52557_additional_2.map.gz emd_52557_additional_2.map.gz emd_52557_half_map_1.map.gz emd_52557_half_map_1.map.gz emd_52557_half_map_2.map.gz emd_52557_half_map_2.map.gz | 28.6 MB 53.5 MB 52.6 MB 52.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-52557 http://ftp.pdbj.org/pub/emdb/structures/EMD-52557 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-52557 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-52557 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_52557_validation.pdf.gz emd_52557_validation.pdf.gz | 657.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_52557_full_validation.pdf.gz emd_52557_full_validation.pdf.gz | 657.3 KB | 表示 | |
| XML形式データ |  emd_52557_validation.xml.gz emd_52557_validation.xml.gz | 16.3 KB | 表示 | |
| CIF形式データ |  emd_52557_validation.cif.gz emd_52557_validation.cif.gz | 21 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52557 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52557 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52557 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52557 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_52557.map.gz / 形式: CCP4 / 大きさ: 56.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_52557.map.gz / 形式: CCP4 / 大きさ: 56.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of holo-GmNifEN sharped with EMready | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.14 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: CryoEM structure of holo-GmNifEN unsharped
| ファイル | emd_52557_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of holo-GmNifEN unsharped | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: CryoEM structure of holo-GmNifEN sharped
| ファイル | emd_52557_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of holo-GmNifEN sharped | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: CryoEM structure of holo-GmNifEN
| ファイル | emd_52557_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of holo-GmNifEN | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: CryoEM structure of holo-GmNifEN
| ファイル | emd_52557_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of holo-GmNifEN | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : nitrogenase iron-molybdenum cofactor biosynthesis protein NifEN
| 全体 | 名称: nitrogenase iron-molybdenum cofactor biosynthesis protein NifEN |
|---|---|
| 要素 |
|
-超分子 #1: nitrogenase iron-molybdenum cofactor biosynthesis protein NifEN
| 超分子 | 名称: nitrogenase iron-molybdenum cofactor biosynthesis protein NifEN タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Geobacter metallireducens (バクテリア) Geobacter metallireducens (バクテリア) |
| 分子量 | 理論値: 199.774 KDa |
-分子 #1: Nitrogenase iron-molybdenum cofactor biosynthesis protein NifE
| 分子 | 名称: Nitrogenase iron-molybdenum cofactor biosynthesis protein NifE タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Geobacter metallireducens (バクテリア) / 株: strain ATCC 53774 / DSM 7210 / GS-15 Geobacter metallireducens (バクテリア) / 株: strain ATCC 53774 / DSM 7210 / GS-15 |
| 分子量 | 理論値: 100.135594 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAKPDYYDVS ECETHEKGAP KFCKKSEPGE GAERSCAYDG ARVVLMPITD VIHLVHGPIA CAGNSWDNRG ARSSDSQLYR RGFTTEMLE NDVVFGGEKK LYRAILELAE RYEGQAKAMF VYATCVTAMT GDDVEAVCAA AGKKVAIPLI PVNTPGFIGD K NIGNRLAG ...文字列: MAKPDYYDVS ECETHEKGAP KFCKKSEPGE GAERSCAYDG ARVVLMPITD VIHLVHGPIA CAGNSWDNRG ARSSDSQLYR RGFTTEMLE NDVVFGGEKK LYRAILELAE RYEGQAKAMF VYATCVTAMT GDDVEAVCAA AGKKVAIPLI PVNTPGFIGD K NIGNRLAG EVLFKHVIGT AEPPVLGEYP INLIGEYNIA GDLWGMLPLF ERLGIQVLSC FSGDATFEEL RYAHRAKLNI II CSKSLTN LARKMQKNYG MPYLEESFYG MTDTAKALRD IARELDDAVG GLEKRIMQDR VEKLLEEEEA TCRERLAPYR ARL EGKRSV LFTGGVKTWS MVNALRELGV EILAAGTQNS TLEDFYRMKA LMHQDARIIE DTSSAGLLQV MYDKMPDLIV AGGK TKFLA LKTKTPFLDI NHGRSHPYAG YEGMVTFAKQ LDLTVNNPIW PVLNAKAPWE KTEEELTAAV ALAAGHARAC LDEDL KDST VKVPAKNATV NPQKNSPALG ATLAYLGIDQ MLALLHGAQG CSTFIRLQLS RHFKEPVALN STAMSEDTAI FGGWEN LKK GLKKVIEKFS PEVVGVMTSG LTETMGDDVR SAIVHFRQEY PEHDGVPVVW ASTPDYCGSL QEGYAATVEA IVRSVPE PG ETIPGQVTVL PGAHLTPADV EEVRELCEAF GLDPIIVPDI ANALDGHIDE TVSPLSTGGV SMARIRQAGQ SAATLFIG D SLAKAAEAMT ERCGMPSYGF TSLTGLAQVD RFMETLAAIA GRPIPEKFRR WRSRLMDAMV DSHYQFGLKK VTVALEGDN LKTLVNFLAG MGCEIQAAIA ATRVRGLDGL PARDIFVGDL EDLETAARGS DLIVANSNGR QAAAKLGIKA HLRAGLPVFD RLGAHQKMW VGYRGTMNLL FETANLFQAN AGEGQKLAHN UniProtKB: Nitrogenase iron-molybdenum cofactor biosynthesis protein NifE |
-分子 #2: IRON/SULFUR CLUSTER
| 分子 | 名称: IRON/SULFUR CLUSTER / タイプ: ligand / ID: 2 / コピー数: 2 / 式: SF4 |
|---|---|
| 分子量 | 理論値: 351.64 Da |
| Chemical component information |  ChemComp-FS1: |
-分子 #3: FeFe cofactor
| 分子 | 名称: FeFe cofactor / タイプ: ligand / ID: 3 / コピー数: 2 / 式: S5Q |
|---|---|
| 分子量 | 理論値: 747.356 Da |
| Chemical component information | 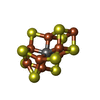 ChemComp-S5Q: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| ||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER/RHODIUM / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 前処理 - 雰囲気: AIR / 詳細: 30 mA | ||||||||
| 凍結 | 凍結剤: PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 2-40 / 撮影したグリッド数: 1 / 実像数: 2758 / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 36000 |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | Chain - Source name: AlphaFold / Chain - Initial model type: in silico model |
|---|---|
| ソフトウェア | 名称: PHENIX (ver. 1.21.1_5286:) |
| 詳細 | AlphaFold Model of gmNifEN |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
| 得られたモデル |  PDB-9i0g: |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















































