+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PKD2 ion channel, R638C variant | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Ion channel / MEMBRANE PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報detection of nodal flow / metanephric smooth muscle tissue development / metanephric cortex development / metanephric cortical collecting duct development / metanephric distal tubule development / polycystin complex / mesonephric tubule development / mesonephric duct development / metanephric part of ureteric bud development / renal tubule morphogenesis ...detection of nodal flow / metanephric smooth muscle tissue development / metanephric cortex development / metanephric cortical collecting duct development / metanephric distal tubule development / polycystin complex / mesonephric tubule development / mesonephric duct development / metanephric part of ureteric bud development / renal tubule morphogenesis / determination of liver left/right asymmetry / HLH domain binding / metanephric ascending thin limb development / metanephric mesenchyme development / metanephric S-shaped body morphogenesis / basal cortex / renal artery morphogenesis / positive regulation of inositol 1,4,5-trisphosphate-sensitive calcium-release channel activity / calcium-induced calcium release activity / migrasome / cilium organization / VxPx cargo-targeting to cilium / detection of mechanical stimulus / muscle alpha-actinin binding / regulation of calcium ion import / voltage-gated monoatomic ion channel activity / placenta blood vessel development / cellular response to hydrostatic pressure / cation channel complex / cellular response to fluid shear stress / outward rectifier potassium channel activity / actinin binding / cellular response to osmotic stress / non-motile cilium / determination of left/right symmetry / voltage-gated monoatomic cation channel activity / inorganic cation transmembrane transport / aorta development / neural tube development / motile cilium / voltage-gated sodium channel activity / ciliary membrane / branching involved in ureteric bud morphogenesis / protein heterotetramerization / negative regulation of G1/S transition of mitotic cell cycle / spinal cord development / cytoplasmic side of endoplasmic reticulum membrane / heart looping / centrosome duplication / voltage-gated potassium channel activity / cell surface receptor signaling pathway via JAK-STAT / potassium channel activity / embryonic placenta development / voltage-gated calcium channel activity / transcription regulator inhibitor activity / monoatomic cation channel activity / cytoskeletal protein binding / cellular response to cAMP / release of sequestered calcium ion into cytosol / potassium ion transmembrane transport / sodium ion transmembrane transport / cellular response to calcium ion / cytoplasmic vesicle membrane / liver development / basal plasma membrane / lumenal side of endoplasmic reticulum membrane / cellular response to reactive oxygen species / establishment of localization in cell / phosphoprotein binding / protein tetramerization / calcium ion transmembrane transport / Wnt signaling pathway / intracellular calcium ion homeostasis / calcium ion transport / mitotic spindle / positive regulation of nitric oxide biosynthetic process / cell-cell junction / lamellipodium / regulation of cell population proliferation / heart development / ATPase binding / positive regulation of cytosolic calcium ion concentration / basolateral plasma membrane / protein homotetramerization / transmembrane transporter binding / cell surface receptor signaling pathway / regulation of cell cycle / ciliary basal body / cilium / signaling receptor binding / negative regulation of cell population proliferation / calcium ion binding / positive regulation of gene expression / endoplasmic reticulum membrane / endoplasmic reticulum / Golgi apparatus / protein homodimerization activity / positive regulation of transcription by RNA polymerase II / extracellular exosome / identical protein binding 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||||||||
 データ登録者 データ登録者 | Esarte Palomero O / DeCaen PG | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Acta Crystallogr D Struct Biol / 年: 2018 ジャーナル: Acta Crystallogr D Struct Biol / 年: 2018タイトル: ISOLDE: a physically realistic environment for model building into low-resolution electron-density maps. 著者: Tristan Ian Croll /  要旨: This paper introduces ISOLDE, a new software package designed to provide an intuitive environment for high-fidelity interactive remodelling/refinement of macromolecular models into electron-density ...This paper introduces ISOLDE, a new software package designed to provide an intuitive environment for high-fidelity interactive remodelling/refinement of macromolecular models into electron-density maps. ISOLDE combines interactive molecular-dynamics flexible fitting with modern molecular-graphics visualization and established structural biology libraries to provide an immersive interface wherein the model constantly acts to maintain physically realistic conformations as the user interacts with it by directly tugging atoms with a mouse or haptic interface or applying/removing restraints. In addition, common validation tasks are accelerated and visualized in real time. Using the recently described 3.8 Å resolution cryo-EM structure of the eukaryotic minichromosome maintenance (MCM) helicase complex as a case study, it is demonstrated how ISOLDE can be used alongside other modern refinement tools to avoid common pitfalls of low-resolution modelling and improve the quality of the final model. A detailed analysis of changes between the initial and final model provides a somewhat sobering insight into the dangers of relying on a small number of validation metrics to judge the quality of a low-resolution model. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_46979.map.gz emd_46979.map.gz | 2.3 GB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-46979-v30.xml emd-46979-v30.xml emd-46979.xml emd-46979.xml | 25.3 KB 25.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_46979_fsc.xml emd_46979_fsc.xml | 28.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_46979.png emd_46979.png | 186.5 KB | ||
| マスクデータ |  emd_46979_msk_1.map emd_46979_msk_1.map | 2.4 GB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-46979.cif.gz emd-46979.cif.gz | 7.2 KB | ||
| その他 |  emd_46979_additional_1.map.gz emd_46979_additional_1.map.gz emd_46979_half_map_1.map.gz emd_46979_half_map_1.map.gz emd_46979_half_map_2.map.gz emd_46979_half_map_2.map.gz | 1.2 GB 2.2 GB 2.2 GB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-46979 http://ftp.pdbj.org/pub/emdb/structures/EMD-46979 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-46979 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-46979 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9dliMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_46979.map.gz / 形式: CCP4 / 大きさ: 2.4 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_46979.map.gz / 形式: CCP4 / 大きさ: 2.4 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.3235 Å | ||||||||||||||||||||||||||||||||||||
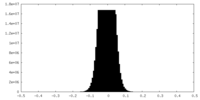
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_46979_msk_1.map emd_46979_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
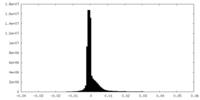
| 密度ヒストグラム |
-追加マップ: Unsharpened map
| ファイル | emd_46979_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_46979_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_46979_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : PKD2 R638C variant protomer
| 全体 | 名称: PKD2 R638C variant protomer |
|---|---|
| 要素 |
|
-超分子 #1: PKD2 R638C variant protomer
| 超分子 | 名称: PKD2 R638C variant protomer / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 84.95 kDa/nm |
-分子 #1: Polycystin-2
| 分子 | 名称: Polycystin-2 / タイプ: protein_or_peptide / ID: 1 / 詳細: PKD2 (52-793), R638C variant / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 85.049383 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GEIEMQRIRQ AAARDPPAGA AASPSPPLSS CSRQAWSRDN PGFEAEEEEE EVEGEEGGMV VEMDVEWRPG SRRSAASSAV SSVGARSRG LGGYHGAGHP SGRRRRREDQ GPPCPSPVGG GDPLHRHLPL EGQPPRVAWA ERLVRGLRGL WGTRLMEESS T NREKYLKS ...文字列: GEIEMQRIRQ AAARDPPAGA AASPSPPLSS CSRQAWSRDN PGFEAEEEEE EVEGEEGGMV VEMDVEWRPG SRRSAASSAV SSVGARSRG LGGYHGAGHP SGRRRRREDQ GPPCPSPVGG GDPLHRHLPL EGQPPRVAWA ERLVRGLRGL WGTRLMEESS T NREKYLKS VLRELVTYLL FLIVLCILTY GMMSSNVYYY TRMMSQLFLD TPVSKTEKTN FKTLSSMEDF WKFTEGSLLD GL YWKMQPS NQTEADNRSF IFYENLLLGV PRIRQLRVRN GSCSIPQDLR DEIKECYDVY SVSSEDRAPF GPRNGTAWIY TSE KDLNGS SHWGIIATYS GAGYYLDLSR TREETAAQVA SLKKNVWLDR GTRATFIDFS VYNANINLFC VVRLLVEFPA TGGV IPSWQ FQPLKLIRYV TTFDFFLAAC EIIFCFFIFY YVVEEILEIR IHKLHYFRSF WNCLDVVIVV LSVVAIGINI YRTSN VEVL LQFLEDQNTF PNFEHLAYWQ IQFNNIAAVT VFFVWIKLFK FINFNRTMSQ LSTTMSRCAK DLFGFAIMFF IIFLAY AQL AYLVFGTQVD DFSTFQECIF TQFCIILGDI NFAEIEEANR VLGPIYFTTF VFFMFFILLN MFLAIINDTY SEVKSDL AQ QKAEMELSDL IRKGYHKALV KLKLKKNTVD DISESLRQGG GKLNFDELRQ DLKGKGHTDA EIEAIFTKYD QDGDQELT E HEHQQMRDDL EKEREDLDLD UniProtKB: Polycystin-2 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.0 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 0.026000000000000002 kPa | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 278 K / 装置: LEICA EM GP | |||||||||||||||
| 詳細 | Stabilized in amphipol A8-35. Monodisperse sample after gel filtration in Superdex 200 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 10 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / デジタル化 - サイズ - 横: 11520 pixel / デジタル化 - サイズ - 縦: 8184 pixel / 撮影したグリッド数: 1 / 実像数: 50 / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | Chain - Source name: AlphaFold / Chain - Initial model type: in silico model |
|---|---|
| 精密化 | 空間: REAL / 温度因子: 113.1 |
| 得られたモデル |  PDB-9dli: |
 ムービー
ムービー コントローラー
コントローラー





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)